Группа редокс-биологии
Группа редокс-биологии основана в 2019 году в составе отдела Метаболизма и редокс-биологии под руководством Всеволода Вадимовича Белоусова.
Группа проводит исследования окислительно-восстановительных процессов, связанных с продукцией пероксида водорода в живых системах. Пероксид водорода является одной из активных форм кислорода (АФК), незаряженной и наиболее стабильной, и принимает участие в огромном количестве химических реакций внутри клетки, тесно связанных с внутриклеточной передачей сигнала. В группе используется хемогенетический инструмент на основе оксидазы D-аминокислот (DAAO), которая, метаболизируя D-аминокислоты, производит в качестве побочного продукта пероксид водорода. Доставляя ген DAAO c помощью генетических векторов на основе рекомбинантных аденоассоциированных вирусов в клетки нервной системы модельных животных (мышей), группа изучает, как искусственно вызванный внутриклеточный окислительный стресс влияет на функции мозга. Такой подход позволяет смоделировать процессы, происходящие в мозге при старении, и ответить на один из ключевых вопросов современной нейронауки: является ли окислительный стресс причиной таких социально значимых нейродегенеративных заболеваний, как болезни Альцгеймера и Паркинсона, или же представляет собой вторичное явление из-за какого-то другого патологического процесса.
Также группа разрабатывает термогенетические инструменты для управления профилем кальциевого сигнала и мембранным потенциалом в живых системах на уровне клетки, ткани, а также индивидуальных живых организмов in vivo. Для этого в целевые клетки c помощью генетических векторов на основе рекомбинантных аденоассоциированных вирусов доставляются термочувствительные неселективные катионные каналы семейства TRP. Небольшие (буквально на 3-5 °С) нагревы клеток с помощью инфракрасного лазера приводят к открытию каналов, поступлению в клетки ионов кальция и деполяризации мембраны. Этот подход позволяет, например, управлять активностью нервных клеток и имеет все перспективы в будущем стать биомедицинской технологией, которая позволит корректировать дефицит клеточных функций при разнообразных патологиях.
В группе проводятся исследования жизненного цикла стволовых клеток и нейрогенеза во взрослом мозге мышей. В рамках проекта ведется разработка методов маркирования ключевых этапов нейрогенного конвейера и поиск факторов, влияющих на различные стадии гиппокампального нейрогенеза. Эти исследования помогут определить собственные возможности мозга для замещения поврежденных или утраченных нейронов и коррекции дефицита неврологических и умственных функций при старении или нейродегенеративных заболеваниях.
Проекты группы выполняется в тесном сотрудничестве с лабораторией молекулярных технологий (рук. член-корр. РАН, д.б.н. В.В. Белоусов), группой фотоники и нелинейной спектроскопии (МГУ им. М.В. Ломоносова, рук. проф., д. ф.-м. н., А.М. Жёлтиков), лабораторией электрофизиологии (ФЦМН ФМБА России, рук. к.б.н. А.В. Розов) и рядом подразделений РНИМУ им. Пирогова.
Окислительный стресс и редокс регуляция клеток мозга.
Функционирование мозга является весьма энергозатратным процессом. Нейроны расходуют вырабатываемую энергию в виде молекул АТФ на поддержание достаточно низкого потенциала покоя клеточной мембраны, на восстановление ионных градиентов на клеточной мембране и цитоплазматической концентрации кальция после генерации потенциала действия, а также на биосинтез нейромедиоаторов и визикулярный транспорт. Нейроны добывают энергию из реакций окислительного фосфорилирования в митохондриях, и для этого им необходим кислород. Об интенсивном энергетическом метаболизме мозга говорит следующий факт: мозг человека, который занимает примерно 2% от общей массы тела, потребляет 20% от всего вдыхаемого кислорода. Почему же мозгу нужно так много энергии. Дело в том, что среди всех клеток в организме нейроны имеют самое большое соотношение площади поверхности мембраны к объему клетки, и на всей этой площади поверхности мембраны нейроны должны поддерживать потенциал покоя и восстанавливать ионные градиенты. Интенсивный кислород-зависимый энергетический метаболизм нейронов неизбежно сопровождается продукцией активных форм кислорода (АФК). Антиоксидантные системы клеток нейтрализуют избыток АФК, таким образом координируя редокс-зависимый сигналинг и снижая их повреждающее действие на клеточные компоненты. Нарушение баланса между продукцией и нейтрализацией АФК к состоянию окислительного стресса. Нейроны мозга крайне чувствительны к окислительному стрессу: они имеют относительно слабую систему антиоксидантной защиты, а их синаптические мембраны обогащены полиненасыщенными жирными кислотами – главными мишенями для перекисного окисления липидов. Хорошо известно, что дефицит умственных функций при старении мозга, а также болезнь Альцгеймера характеризуются появлением признаков окислительного стресса нервных клеток: продуктов перекисного окисления липидов и нежелательных модификаций в белках и нуклеиновых кислотах. Вопрос о том, является ли окислительный стресс причиной таких патологических состояний мозга или представляет собой лишь вторичное явление, остается открытым.
Чтобы ответить на него мы применяем хемогенетический инструмент на основе оксидазы D-аминокислот из дрожжей (DAAO). Этот стереоспецифический фермент катализирует реакцию окислительного дезаминирования D-аминокислот, в результате которой образуется пероксид водорода из молекулярного кислорода (Фигура 1). Пероксид водорода является самой стабильной молекулой АФК. В норме он подвергается нейтрализации антиоксидантными системами клетки, а также обеспечивает редокс-зависимый сигналинг через пострансляционные изменения белков в остатках цестина и метионина. При его избытке в клетках он опосредовано через другие виды АФК повреждает основные клеточные компоненты, и таким образом возникает состояние окислительного стресса.
Используя хемогенетический инструмент на основе DAAO, мы изучаем закономерности редокс-зависимого сигналинга в клетках и создаем модели дисфункции мозга в условиях искусственно вызванного окислительного стресса для того, чтобы ответить на вопрос о роли окислительного стресса в нейродегенерации и исследовать патогенетические механизмы нейродегенеративных заболеваний.
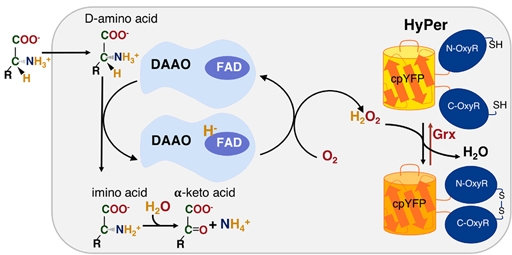
Фигура 1. Хемогенетическая продукция пероксида водорода в клетках с помощью оксидазы D-аминокислот (DAAO) из дрожжей (Smolyarova et. al., 2021, FEBS Journal, doi: 10.1111/febs.16088).
Разработка термогенетических модуляторов на основе терморецепторов для управления активностью нервных клеток.
Терморецепторы большинства организмов, представленные каналами TRPA1 и TRPV1 относящимися к суперсемейству TRP (Transient Receptor Potential), являются неселективными катионными каналами, т.е. способны при активации пропускать гидратированные катионы натрия, калия, кальция и магния. При активации терморецепторов, в клетки преимущественно поступают катионы кальция, т.к. градиент между внутри- и внеклеточной концентрациями этого катиона максимален. Проводимость термочувствительных каналов TRPA1 и TRPV1 на 3 порядка больше, чем у натриевых светочувсвительных каналов ChRs (Channelrhodopsins), которые используются в оптогенетике. Термочувствительные TRP каналы быстро активируются и инактивируются, т.к. являются рецепторами физического воздействия (температуры), а также имеют ряд химических агонистов, способных приводить к их активации (алилизотиоционат, капсаицин и т.д.) за счет окисления остатков цистеина в С-чувствительной части канала.
Термогенетика представляет собой подход для управления активностью клеток с помощью термоактивируемых каналов суперсемейства TRP, применимый как для модельных клеточных культур, так и для животных in vivo. Для того, чтобы активировать клетки необходимо доставить в них генетическую конструкцию, кодирующую термочувствительный рецептор, а затем слегка, буквально на несколько градусов нагреть клетки. Канал откроется, и катионы кальция начнут поступать в цитоплазму. Это приводит к деполяризации клеточной мембраны и активации кальций-зависимых процессов в клетках. Для того, чтобы активировать клетки изменением температуры их слегка подогревают излучением инфракрасного лазера.
В нашей группе мы развиваем методы термогенетики на млекопитающих. Млекопитающие являются гомойотермными животными. Это накладывает определенные ограничения на термочувствительные каналы, которые могут быть использованы для термогенетики на млекопитающих. Они должны быть функциональны, т.е. быть способными отвечать на стимулы, и находится в закрытом состоянии при температуре тела модельных грызунов (мышей и крыс) 37°С. Их пороговая температура активации должна быть около 40°С, поскольку температура тела 42°С. В этой связи наиболее перспективными каналами для активации клеток млекопитающих являются канал TRPV1 человека с пороговой температурой активации 42°С и канал TRPA1 курицы с пороговой температурой активации 40°С. Применение для термогенетики канала TRPV1 человека делает термогенетику транслируемой в медицину, а канал TRPA1 курицы из-за своей способности сохранять термочувствительность при длительных нагревах может обеспечить большое разнообразие сценариев термоактивации клеток (каналы TRPA1 млекопитающих не являются термочувствительными).
Главными преимуществами термогенетики над оптогенетикой являются: транслируемость в медицину (каналродопсины, применяемые в оптогенетике, происходят из водорослей и вольвокса, что влечет иммунологические проблемы применения этих каналов в медицине), высокая проводимость каналов, исключающая фототоксическое повреждение клеток, возможность применять термогенетику для активации не только возбудимых клеток, но и вообще любых клеток, и возможность совмещать термоактивацию и кальциевый имиджинг в режиме реального времени (Фигура 2).
Молекулярные инструменты термогенетики прекрасно зарекомендовали себя в наших экспериментах по стимуляции нейронов млекопитающих как in vitro, так и in vivo. Мы применяем эти инструменты для изучения роли афферентных проекций в гиппокамп в функционировании гиппокампальной нервной сети и для разработки подходов для коррекции патологических состояний мозга, как, например, эпилепсия или болезнь Паркинсона.
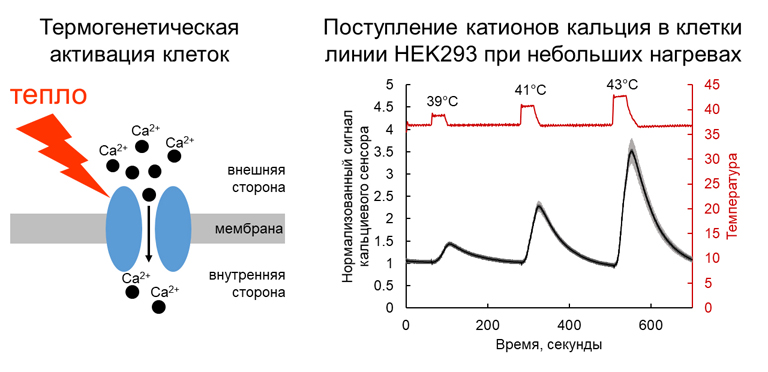
Фигура 2. Термогенетическая активация клеток и поступление катионов кальция в клетки линии HEK293, которые экспрессируют канал TRPA1 курицы, при небольших нагревах.
| ФИО | Должность | Контакты |
|---|---|---|
| Подгорный Олег Владимирович, к.б.н. | с.н.с. | |
| Титов С.А. | н.с. | |
| Зыкова Л.А. | м.н.с. | |
| Мальцев Д.И. | м.н.с. | |
| Елесина Е.А. | инженер | |
| Носова А.Е. | тех.-лаб. | |
| Цопина А.С. | тех.-лаб. | |
| Гуськова В.О. | инженер | |
| Петухова Е.О. | инженер | |
| Соколов Р.А. | инженер | |
Ранее здесь работали | ||
| Ермакова Ю.Г., к.б.н. | ||
| Солюс Г.М. | ||
| Пак В.В. | ||
| Калиниченко Андрей Леонидович | ||
| Мухаметшина Л.Ф. | ||
 Загрузка...
Загрузка...Научные проекты
 Загрузка...
Загрузка...Подгорный Олег Владимирович
Москва, ул. Миклухо-Маклая, 16/10 — На карте
 Загрузка...
Загрузка...
