Лаборатория рентгеноструктурных исследований биополимеров
|
Руководитель: Плетнёв Владимир Захарович |
Лаборатория занимается исследованиями пространственной структуры и структурно-функциональной взаимосвязи соединений пептидно-белковой природы методами рентгеноструктурного анализа высокого разрешения, методами молекулярной механики, динамики, графики и биоинформатики. .
Лаборатория исследует белки различной функциональной природы с акцентом на структурно-функциональные аспекты специфичности узнавания и связывания лигандов/субстратов.
Лаборатория сотрудничает с лабораторией Кристаллографии макромолекул Национального Института Рака США (Аргонн, Иллинойс, США).
Лаборатория была образована в 1990 году на базе соответствующей группы, функционирующей с 1972 года.

Сотрудники Лаборатории.
В последнее время в лаборатории большое внимание уделяется структурным исследованиям флуоресцентных белков (ФБ), используемых в клеточной биологии, биотехнологии и биомедицине в качестве молекулярных бионаномаркеров для визуализации внутренних биологических процессов в клетках или целом организме. Сотрудники установили пространственную структуру большой серии ФБ с эмиссией в зеленой, желтой, красной и дальне-красной спектральных областях при помощи метода рентгеноструктурного анализа высокого разрешения. Анализ структурно-функциональной взаимосвязи исследуемых объектов позволил объяснить многие экспериментально наблюдаемые свойства и сконструировать новые мутантные флуоресцентные варианты с улучшенными фотофизическими характеристиками. Полученные результаты существенно расширяют структурную базу для рационального дизайна более совершенных биомаркеров для практического применения.
Пространственная структура большой группы циклических депсипептидных ионофоров, отличающихся размерами цикла, природой и конфигурацией остатков позволила установить важные детали, касающиеся специфичности связывания ионов металлов и механизма их транспорта через биологические мембраны.
Совместно с Медицинским Исследовательским Институтом имени Хауптмана-Вудвард (Буффало, США) выполнена серия работ под общим названием «Рациональная протеомика семейства короткоцепочечных дегидрогеназ». Для этого семейства был разработан подход для идентификации трехмерной совокупности остатков («отпечатки пальцев»), ответственных за формирование трехмерной структуры белка, связывание кофакторов и субстратов.
Установлена пространственная структура большой серии ФБ с эмиссией в зеленой, желтой, красной и дальне-красной спектральных областях. Последующий анализ структурно функциональной взаимосвязи исследуемых объектов позволил объяснить многие экспериментально наблюдаемые свойства и сконструировать новые мутантные флуоресцентные варианты с улучшенными фотофизическими характеристиками.

Морские кораллы, анемоны, полипы - источники флуоресцентны систем (a); Структурная организация ФБ представляет собой β-цилиндр сформированный из 11 β-тяжей. Вдоль оси цилиндра проходит a-спираль, в центре которой располагается хромофор, образованный из 3-х остатков в результате посттрансляционной модификции (b).

Кристаллы флуоресцентных белков для рентгеноструктурного анализа
Уникальные примеры флуоресцентных белков, полученных в лаборатории
I. Структурные исследования дальне-красного мономерного белка mKate показали, что наблюдаемая у него необычная рН зависимость флуоресценции является следствием цис-транс изомеризации внутреннего хромофора. На основе анализа пространственной структуры mKate был предсказан и рациональным способом сконструирован новый генно-инженерный вариант mKate_S158A с почти вдвое улучшенной яркостью. В настоящее время фотофизические характеристики полученного варианта существенно превосходят аналогичные параметры всех известных флуоресцентных мономерных биомаркеров.
Изучение структуры высокотоксичных красного и оранжевого флуоресцентных белков, KillerRed и KillerOrange, позволило установить в окружении хромофоров ключевые аминокислотные остатки, участвующие в генерации активных форм кислорода, вызывающих фототоксический эффект.
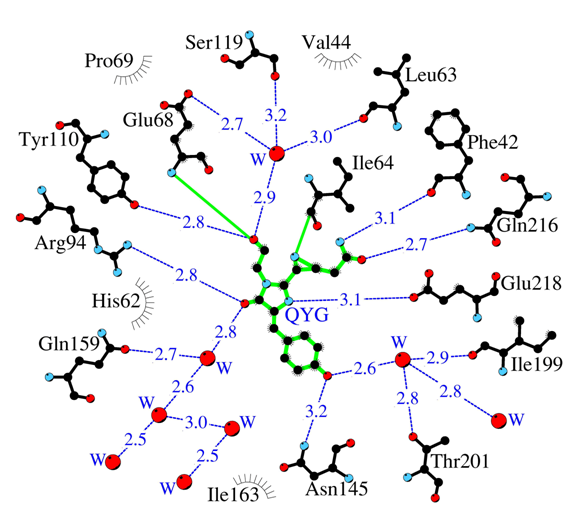
Аминокислотное окружение внутреннего хромофора сильно токсичного красного флюоресцентного белка KillerRed. Водородные связи (≤3.3 Å) показаны синими штриховыми линиями, молекулы воды (W) красными шариками и ван дер Ваальсовы контакты (≤3.9 Å) — черными «ресничками».
II. В кристаллической структуре бесцветного нефлуоресцентного ФБ, aceGFP-G222E была обнаружена промежуточная форма биосинтеза хромофора. Эта впервые экспериментально наблюдаемая структура незрелого хромофора, характеризуемая некопланарным расположением имидазолинонового и фенольного циклов, где циклизация основной цепи уже осуществилась, однако Tyr66 хромофора все еще остается в нативном неокисленном состоянии с атомами Cα and Cβ в sp3 гибридизации.
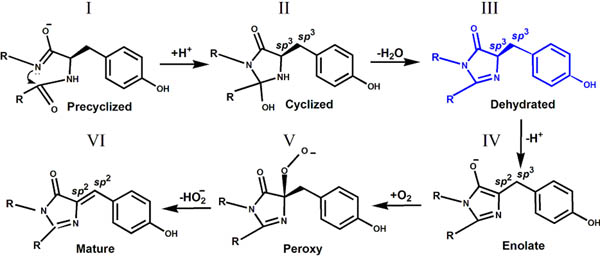
Промежуточное состояние (форма III) биосинтеза GFP хромофора в кристаллической структуре aceGFP-G222E
III.
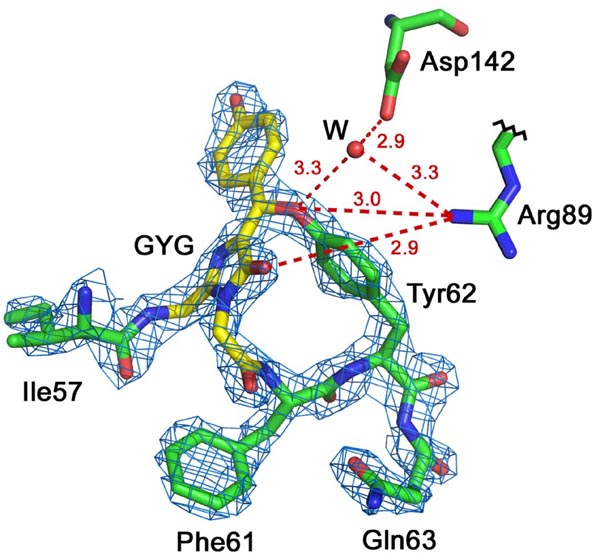
Красный флуоресцентный белок laRFP из ланцетника. Хромофор Gly58-Tyr59-Gly60 (GYG; показан желтым цветом) в электронной плотности 2Fo-Fc (уровень плотности ρ= 2.0σ). В laRFP показано наличие ковалентной связи между атомом Cβ Tyr59 хромофора и близлежащим атомом O Tyr62. Asp142 при участии молекулы воды (W) образует H-связь с Tyr62 (показана красным пунктиром). Arg89 образует H-связь с Tyr62, что может облегчать перенос протона к Asp142 в процессе формирования хромофора.
IV.
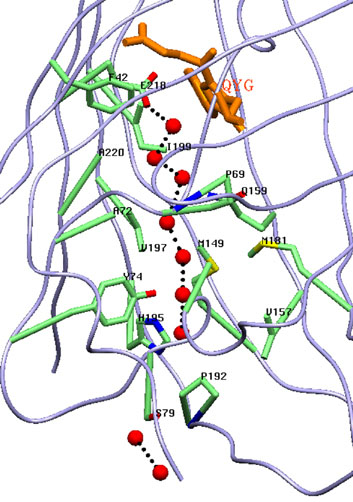
Канал, простирающейся вдоль β-бочонка, заполнен цепочкой из связанных водородными связями молекул воды, выполняющей роль транспортной системы для фотогенерируемых токсичных супероксид анионов.
V. Впервые, установлена пространственная структура DendFP (Dendronephthya sp.) в нативной зеленой форме и УФ облученной фотоконвертированной красной форме, демонстрирующей разрыв основной цепи перед хромофором.
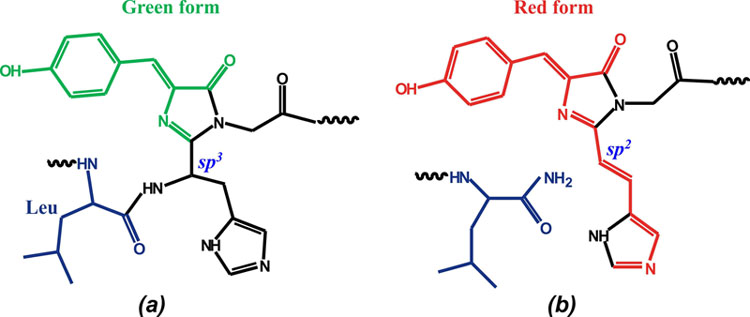
Структура хромофора (His62-Trp63-Gly64) в зеленом DendGFP (a) и красном DendRFP (b).
VI. По линии международного сотрудничества методом рентгеноструктурного анализа установлены пространственные структуры и изучена структурно-функциональная взаимосвязь трех новых ярких генно-инженерных биомаркеров (на основе растительных фоторецепторов - фитохромов) дальне-красного и ближнего инфракрасного диапазонов, обеспечивающих высокую проницаемость излучения через биологические ткани - miRFP670 (эм ~670нм), (miRFP703 (703нм) and miRFP709 (709 нм)
с разрешением 1.33, 1.35 и 1.34Å, соответственно
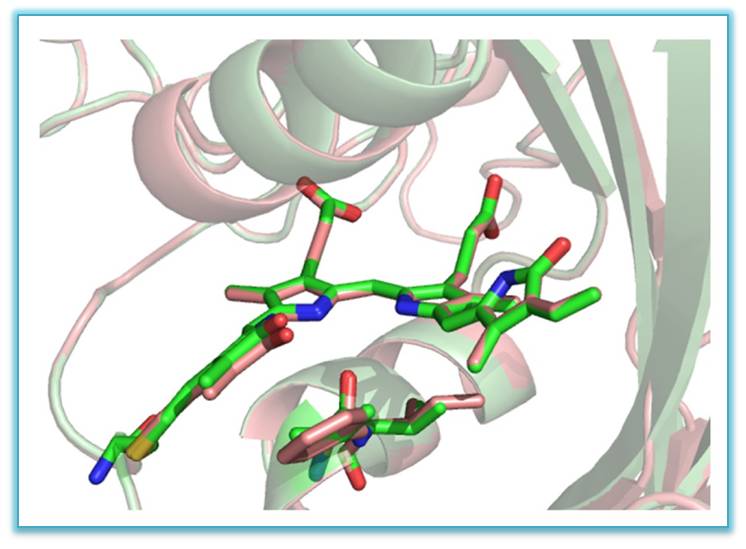
Совмещенные структуры флуоресцентных белков ближнего инфракрасного диапазона –
miRFP703 (показана зеленым цветом) and miRFP709 (показана розовым цветом) с хромофором в центре в связывающей полости
| ФИО | Должность | Контакты |
|---|---|---|
| Плетнёв Владимир Захарович, д.х.н. | зав. лаб. | |
| Артемьев Игорь Владимирович | н.с. | |
| Горячева Екатерина Александровна, к.б.н. | н.с. | |
| Архипова Светлана Федоровна | ст. инж. | |
| Россохин А.В. | ст. инж. | |
Ранее здесь работали | ||
| Цыганник И.Н., к.ф.-м.н. | ||
 Загрузка...
Загрузка...Научные проекты
 Загрузка...
Загрузка... Загрузка...
Загрузка...
