Пресс-центр / новости / Наука /
Обнаружен новый фундаментальный принцип убиквитин-независимого гидролиза белков протеасомой
Одним из возможных механизмов развития рассеянного склероза является разрушение миелиновой оболочки и дальнейший протеолиз основного белка миелина протеасомой, после чего продукты деградации белка презентируются на молекулах MHC I класса и распознаются цитотоксическими T-лимфоцитами. Группа ученых лаборатории биокатализа под руководством д.х.н. Белогурова А.А. продемонстрировала, что основный белок миелина подвергается гидролизу протеасомой убиквитин-независимо, причем движущей силой этой деградации является аномально высокий положительный заряд белка. Гидролиз МВР протеасомой является АТР-независимым и ускоряется в присутствии протеасомных регуляторов REG типа α и γ. Исследование выполнено при поддержке РНФ и опубликовано в журнале FASEB.
Убиквитин-протеасомная система – основная система деградации белков в ядрах и цитоплазме эукариотических клеток, она также вовлечена в патогенез многих нейродегенеративных заболеваний, таких как болезни Альцгеймера и Паркинсона, амиотропный латеральный склероз, прионные болезни и ряд других. Считается также, что протеолитическая деградация является одной из ключевых стадий в разрушении миелина, которое протекает при рассеянном склерозе. Наиболее вероятным является то, что именно протеолитическое расщепление белков является причиной появления аутоантигенов.
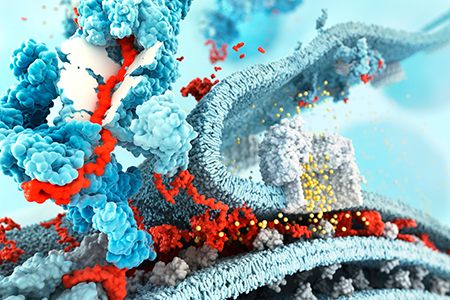
Ранее в лаборатории биокатализа были получены данные, свидетельствующие, что один из основных аутоантигенов при рассеянном склерозе – основный белок миелина (MBP) – способен подвергаться гидролизу протеасомой без предварительного убиквитинирования. По-видимому, протеасомальный гидролиз основного белка миелина является одной из ключевых стадий развития рассеянного склероза, поэтому изучение молекулярного механизма его деградации представляется важным и интересным как с фундаментальной, так и клинической точки зрения.
Сотрудниками лаборатории была осуществлена экспериментальная проверка выдвинутого ранее в отношении MBP предположения, что главным фактором его ассоциации с протеасомой выступает не специфическая аминокислотная последовательность, а наличие в его составе большого числа основных аминокислот, таких как лизин и аргинин и, как следствие, высокий положительный заряд. Создание искусственного дегрона по принципу включения в его состав наиболее представленных в MBP аминокислот позволило подтвердить эту гипотезу: несмотря на утрату специфического мотива, эффективность дегрона была значительно повышена по сравнению с естественными дегронами MBP. В то же время замена положительно заряженных аминокислот на нейтральные значительно уменьшала эффективность деградации, а замена остатков лизинов на несколько более положительные остатки аргинины даже способствовала незначительному повышению скорости гидролиза. Эти данные подтверждают исключительную роль заряда в способности дегрона направлять белки на деградацию в протеасому. Второе важное свойство миелин-подобного дегрона, обусловленное большим содержанием небольших подвижных аминокислот в его последовательности, позволяет ему самостоятельно инициировать собственную транслокацию в протеолитическую камеру. Установленная оптимальная длина в 5 повторяющихся фрагментов соответствует 70 Å, что согласуется с ранее установленными допустимыми длинами инициаторных фрагментов. Стоит отдельно отметить, что для эффективной инициации гидролиза миелин-подобному дегрону требуется почти в два раза более короткий неупорядоченный фрагмент, чем классическим конструкциям, подвергающимся убиквитин-независимому гидролизу, что может свидетельствовать о наличии в протеасоме альтернативного участка связывания основных дегронов. Дальнейшее изучение убиквитин-независимых дегронов поможет пролить свет на механизмы убиквитин-независимой протеасомной деградации и представляет как фундаментальный, так и практический интерес.
5 марта 2019 года

