Лаборатория химии протеолитических ферментов
Лаборатория химии протеолитических ферментов, возглавлявшаяся чл.-корр. РАН В. К. Антоновым, была образована в 1967 году, выделившись из Лаборатории химии антибиотиков, возглавлявшейся академиком М. М. Шемякиным. С 1992 года лабораторией заведует проф. Л. Д. Румш.
В настоящее время лаборатория занимается исследованием структурно-функциональных особенностей функционирования Lon-протеиназы, исследованием регуляторных функций энтеропептидазы и дуоденазы в отношении рецепторов, активируемых протеиназами (PAR), а также выделением и исследованием протеиназ экстремофильных организмов.
Лаборатория активно участвует в научной и педагогической деятельности — подготовлено и защищено три докторских и более 50 кандидатских диссертаций, под руководством сотрудников лаборатории выполнено большое количество студенческих дипломных работ. Лаборатория является организатором постоянно действующего межинститутского семинара «Проблемы и перспективы исследования протеолитических ферментов», а также регулярно организует проведение Всероссийских симпозиумов «Химия протеолитических ферментов».
Основным направлением работ лаборатории является исследование протеиназ, выполняющих регуляторные функции в системах внутриклеточного протеолиза (АТР-зависимые Lon-протеиназы) и процессинга белков (энтеропептидаза, дуоденаза). Кроме того, объектами изучения служат экстремофильные протеиназы, а также протеиназы, являющиеся ключевыми при развитии особо опасных и социально значимых инфекций, вызываемых такими патогенами как Plasmodium falciparum и ВИЧ. Научная деятельность лаборатории направлена не только на решение фундаментальных проблем современной энзимологии (выяснение природы избирательности протеиназ в процессе узнавания белков-мишеней и путей реализации их специфичности, установление механизма функционирования некоторых протеиназ), но и на решение прикладных задач (выделение и изучение протеиназ, применяющихся в биотехнологии и в медицине, поиск ингибиторов ряда протеиназ).
Для изучения механизма каталитического акта при функционировании протеолитических ферментов используется метод теоретического конформационного анализа. В лаборатории разработан подход, позволяющий различать механизмы действия пептидгидролаз – общий основной и ковалентный катализ – путем использования тяжелокислородной воды как среды реакции и предложена классификация пептидгидролаз, основанная на различиях в механизмах их действия.
Проводится исследование АТР-зависимых Lon-протеиназ, относящихся к суперсемейству ААА+-белков и играющих ключевую роль в обеспечении сохранности клеточного протеома.
Установлено, что протеолитические активные центры Lon-протеиназ представлены каталитической диадой Ser-Lys, при этом семейство Lon состоит из двух подсемейств (А и В), различающихся окружением каталитических остатков активных центров, структурной организацией АТР-азных доменов и общей архитектурой молекулы. Сравнительное исследование протеиназ LonA из Escherichia coli (ЕcLonА) и LonB из Archaeoglobus fulgidus (AfLonВ) выявило важность четвертичной структуры для реализации процессивного механизма протеолиза.
Рентгеноструктурным анализом показано, что протеолитические домены ЕcLonА и AfLonВ обладают уникальным типом пространственной структуры и образуют в кристалле циклические гексамеры. Мономерный N-концевой субдомен ЕcLonА также имеет уникальную укладку, в то время как структура альфа-спирализованного домена фермента типична для ААА+-белков. Полученные результаты послужили основанием для выведения семейства Lon-протеиназ в индивидуальный клан SJ в базе данных пептидгидролаз MEROPS.
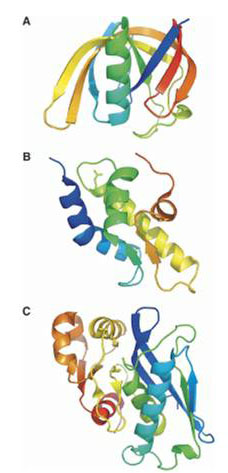
Рис. 1. Пространственные структуры фрагментов LonA-протеиназы из E. coli. А — N-концевой субдомен (остатки (1—119));B — α-спирализованный домен (остатки (491—584));C — протеолитический домен (остатки (585—784)).
В процессе исследования сериновых протеиназ желудочно-кишечного тракта выделен и охарактеризован новый фермент — дуоденаза. Установлена первичная и пространственная структура дуоденазы; обнаружена двойственная (трипсино- и химотрипсиноподобная) специфичность фермента. Показано, что уникальные свойства энтеропептидазы тонкого кишечника, обладающей абсолютной специфичностью, обусловлены сложной доменной организацией при наличии строгой иерархии первичного и двух вторичных субстрат-связывающих центров, один из которых обеспечивает высокую специфичность, а другой — высокую эффективность катализа.
Получены данные, свидетельствующие в пользу того, что дуоденаза может являться специфическим активатором проэнтеропептидазы, т. е. играть ключевую роль в инициации каскада активации протеолитических ферментов пищеварительного тракта. Кроме того, обнаружено, что энтеропептидаза и дуоденаза обладают также регуляторной функцией по отношению к рецепторам семейства PAR.
Впервые получена протеиназа Ulysses (гомологичная протеиназе HIV—1), ген которой был обнаружен в мобильном генетическом элементе Drosophila virilis. Исследованы энзимологические свойства и подтверждена функциональная активность фермента. Методом гомологичного моделирования и молекулярной динамики построена пространственная модель протеиназы Ulysses.
Для аспартатной протеиназы плазмепсин II из малярийного паразита Plasmodium falciparum получены высокоаффинные и специфические ингибиторы.
 Загрузка...
Загрузка...Научные проекты
 Загрузка...
Загрузка...Смирнов Иван Витальевич
Москва, ул. Миклухо-Маклая, 16/10 — На карте
Scopus: 7202245246, ResearcherID: N-5635-2017, ORCID: 0000-0002-0384-6568, Google Scholar
 Загрузка...
Загрузка...

