Пресс-центр / новости / Наука /
«Ахиллесова пята бактериальной мембраны»
В мембране бактерий присутствует интересная молекула – липид II, которая не встречается у эукариот. Этот липид служит важным элементом в построении клеточной стенки бактерий. Его считают весьма перспективной мишенью для создания антибиотиков будущего. Сотрудникам лаборатории Моделирования биомолекулярных систем ИБХ РАН Р. Г. Ефремову, А.О. Чугунову и их коллегам при помощи компьютерного моделирования удалось построить карту поверхности участка мембраны, содержащего липид II. Это помогло понять, каким образом антибиотик находит самое уязвимое место мембраны микроорганизмов. Данной работе была посвящена часть доклада А. О. Чугунова на X Молодежной школе-конференции с международным участием «Актуальные аспекты современной микробиологии».
У бактерий есть специальные вещества – бактериоцины, являющиеся разновидностью природных антибиотиков. Прокариоты могут оказывать воздействие друг на друга, используя эти вещества – например, одни бактерии могут убивать других с помощью бактериоцинов или контролировать рост колоний конкурентов. Эти вещества играют важную роль в микробных экосистемах.
Было замечено, что бактериоцины могут быть полезны и для людей. Дело в том, что для нас они совершенно безвредны, поскольку действуют только на бактериальные клетки. Интересно и то, что с их помощью можно бороться с патогенными микроорганизмами, не нанося ущерба при этом симбионтам человеческого организма. Например, бактериоцины, выделяемые симбиотическими лактобактериями (сем. Lactobacillaceae), убивают патогенных микробов, но совершенно не трогают своих соседей. Многие исследователи считают, что использование бактериоцинов поможет выйти из тупика резистентности патогенных микробов к антибиотикам. Поэтому изучение свойств этих веществ является весьма перспективным направлением.
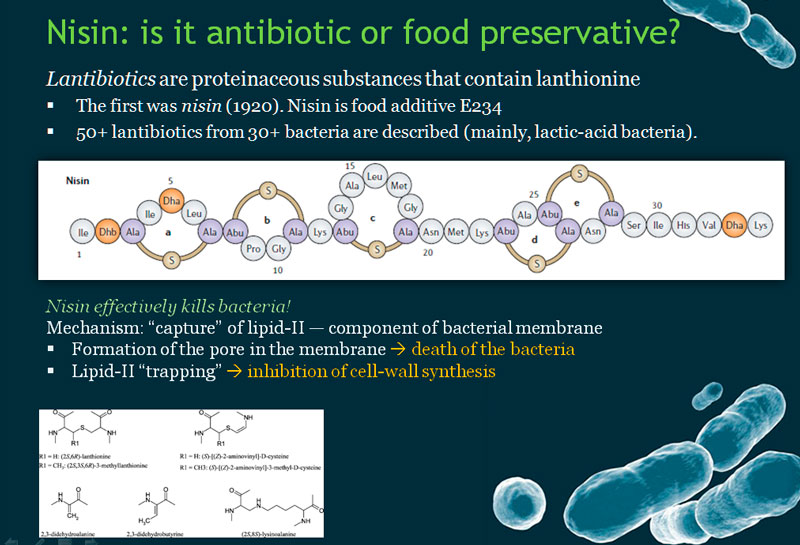
Одним из таких бактериоцинов является низин, который вырабатывает бактерия Streptococcus lactis. Интересно, что это вещество открыли даже раньше, чем первый антибиотик пенициллин. В лекарственных целях его используют редко, в основном это вещество применяют в качестве как пищевой добавки-консерванта (Е234).
Низин
Тем не менее, он эффективно работает в качестве бактерицидного и бактериостатического агента. Причем, как выяснилось, низин целенаправленно воздействует на весьма интересный элемент бактериальных мембран, который называется липид II.
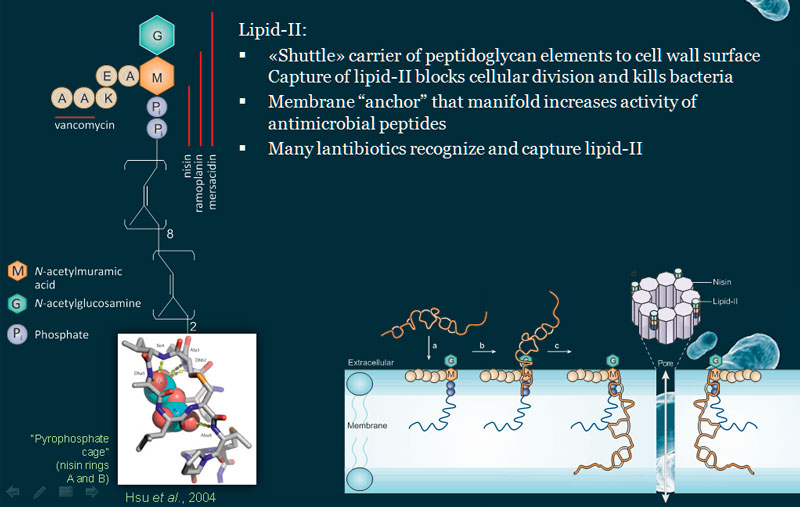
Строение липида II весьма необычно. У него есть терпеновый хвостик, далее расположен пирофосфат, а затем идут два сахара, к одному из которых присоединен пентапептид с необычным строением. Эта оригинальная молекула служит переносчиком фрагмента пептидогликана, строительного материала бактериальной клеточной стенки. Сетка из пептидогликана как бы охватывает бактерию со всех сторон наподобие продуктовой сумки-авоськи, то есть она является очень важным компонентом бактериальной клеточной стенки. Разрушение пептидогликановой сетки обычно приводит к гибели микроорганизма – кроме тех видов (их не так-то и много), у которых такой сетки вообще не образуется.
Таким образом, если липид II каким-нибудь образом «выключить» из этого процесса, то клеточная стенка синтезироваться не будет, и бактерия погибнет. Низин же может «поймать» липид II прямо на бактериальной мембране. Тут возможны два варианта: в первом случае низин просто связывается с молекулой липида II и не дает ей работать, а при втором варианте в мембране формируется пора – низин закрепляется в мембране с помощью липида II и «пробивает» ее. В последнем случае гибель бактерии неизбежна, поскольку происходит рассеивание ионных градиентов.
Липид II
Для того, чтобы создать активные молекулы бактериоцинов, которые могли бы выхватывать из бактериальных мембран липид II и убивать патогенные микроорганизмы, нужно детально изучить все, что происходит на мембране в процессе такого контакта. И вот, сотрудникам лаборатории Моделирования биомолекулярных систем ИБХ РАН Р. Г. Ефремову , А.О. Чугунову и их коллегам удалось смоделировать в компьютерном эксперименте фрагмент мембраны, который содержит липид II. Он встраивается среди обычных бактериальных фосфолипидов – это достаточно сложная система. Расчетное время молекулярной динамики составило 1 мкс (1·10-6с) Нужно было проделать миллиарды шагов для системы, состоящей из сотен тысяч атомов для того, чтобы осуществить такой расчёт. И хотя пока что нельзя увидеть всего, что происходит на мембране, уже сейчас можно утверждать, что присутствие липида II влияет на ее свойства.
Предполагается, что контакт липида II с низином происходит следующим образом - бактериоцин цепляется к пирофосфату липида, и при этом выстраивается специфический паттерн водородных связей, что приводило к высокоаффинному связыванию. Но каким образом низин находит молекулу, которая встречается в мембране не столь уж часто? Может быть, липид II кардинально изменяет свойства того участка мембраны, где он локализован? Сотрудники лаборатории решили выяснить это, построив при помощи компьютерного моделирования карту участка мембраны, содержащего липид II.
В настоящее время известно, что расхожее мнение о расположении всех гидрофобных участков в билипидном слое мембраны исключительно внутри, а гидрофильных – на поверхности, не соответствует действительности. Согласно компьютерному моделированию и новейшим экспериментальным данным, на поверхности мембраны тоже имеются гидрофобные участки, причем их площадь может быть весьма велика. Так вот, исследователи выяснили, что поверхностные участки мембраны, где находятся молекулы липида II, тоже гидрофобны – они формируют своеобразный «гидрофобный атолл». Более того, эти участки неоднородны по рельефу – из-за молекулы липида II там образуются выступы и впадины.
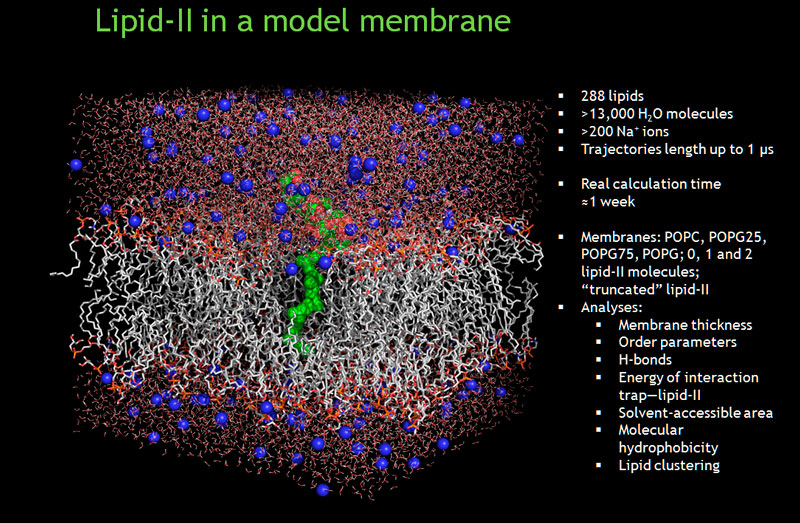
Расположение липида II в мембране
Происходит это вот почему - пентапептидная головка липида, содержащая «строительный блок» для клеточной стенки, находится снаружи мембраны. Терпеновый хвостик липида II свободно болтается внутри последней, принимая иногда самые необычные положения. Ну а соединяющая обе эти части пирофосфатная группа липида II как бы высовывается из мембраны, и, таким образом, она находится на границе между клеткой и водной средой.
Из-за того, что головка этого липида возвышается над поверхностью мембраны, структура бислоя на этом участке оказывается нарушенной, поскольку над ровным слоем фосфолипидов образуется весьма заметный выступ. Но это еще не все – головка липида II образует водородные связи с полярными головками фосфолипидов. Кроме того, положительно заряженный остаток лизина в головке липида II притягивает отрицательно заряженные фрагменты расположенных рядом липидов при за счет электростатических взаимодействий. В итоге получается, что головка липида II как бы «стягивает» на себя окрестные фосфолипидные молекулы, а его хвост, меняя свое расположение внутри гидрофобного слоя, тем самым нарушает его структуру. Так и происходит формирование вышеописанного «атолла», в центре которого находится островок гидрофильности (вокруг головки липида II), а по краям — подковообразный гидрофобный участок, образованный за счет возмущений центральных областей мембраны, вызываемых движением хвоста липида II.

Гидрофобный участок мембраны вокруг липида II
Исходя из этой картины, исследователи предположили, что липид II «выдает» себя бактериоцину тем, что формирует вокруг себя гидрофобную поверхность. Действительно, молекул этого вещества в клетке очень мало – от одной до двух тысяч (у грамположительных бактерий – около 20 тысяч) на миллионы молекул фосфолипидов. Казалось бы, никакой бактериоцин просто не сможет найти столь редкий элемент прокариотической мембраны среди множества совершенно не интересных ему фосфолипидов. Но антимикробный пептид обладает мембранной активностью, поэтому он сначала находит неоднородный с точки зрения гидрофильности участок в мембране, а потом специфически связывается с пирофосфатом. Правда, как именно он находит эту неоднородность, пока не известно – это требует дальнейшего моделирования и расчётов.
Получается, что в данном случае бактерии сами себя выдают, показывая бактериоцинам свое самое уязвимое место. Все это позволяет рассчитывать на то, что данная мишень весьма перспективна для создания принципиально новых антибиотиков. Не исключено, что в дальнейшем исследователи смогут, опираясь на компьютерные расчёты, предложить другие молекулы, которые будут еще более эффективно атаковать эту «ахиллесову пяту» бактериальных мембран. В таком случае останется только синтезировать эти вещества и испытать их на практике. Правда, сразу нужно отметить, что они вряд ли будут хорошо работать против грамположительных бактерий, поскольку те обладают толстой клеточной стенкой, через которую не так-то легко пробиться. Но есть все основания полагать, что с грамотрицательными микроорганизмами эти агенты справятся достаточно легко.
Литература
1) Anton Chugunov, Darya Pyrkova, Dmitry Nolde et al. Lipid-II forms potential «landing terrain» for lantibiotics in simulated bacterial membrane // Scientific Reports. 2006. V. 3. Article number: 1678.
2) Eefjan Breukink and Ben de Kruijff. Lipid-II as a target for antibiotics // Nature Reviews Drug Discovery. 2006. V. 5. P. 321–323.
6 ноября 2015 года

