Пресс-центр / новости / Наука /
Сотрудники ИБХ заставили белки светиться дольше
Учёные ИБХ РАН совместно с российскими и зарубежными коллегами продлили время свечения флуоресцентных маркеров в живых клетках. Свет испускается дольше за счёт непрерывного обмена флуорогенных красителей, взаимодействующих с особыми белковыми метками. Описанный в журнале Chemical Science метод упростит окрашивание живых клеток и предоставит новые возможности для исследований. Работа выполнена при поддержке РНФ.
Способность поглотить свет на определённой длине волны и затем испустить его на большей длине волны называется флуоресценцией. Это физическое явление используют в своей работе биофизики, молекулярные и клеточные биологи. Учёные маркируют белки, чтобы увидеть их расположение и взаимодействие внутри живой клетки, что уже сейчас позволяет диагностировать ряд заболеваний. Для этого часто применяют зелёные флуоресцентные белки (GFP), выделенные из глубоководной медузы эквореи (Aequorea victoria), и их аналоги других цветов. Они представляют собой генетически закодированные метки, которые флуоресцируют сами по себе, то есть без добавления химических веществ извне. Другой способ – пометить белки маркерами, необратимо связывающими испускающие свет молекулы (химические флуорофоры). Этот способ даёт возможности выбора спектров поглощения света, флуоресценции и времени маркировки. Но метод требует долгой подготовки и вымывания «лишнего» красителя.
«Многие испускающие свет молекулы плохо проникают через оболочку живой клетки и медленно связываются с белками-партнёрами, – поясняет Александр Мишин, научный сотрудник Лаборатории биофотоники ИБХ РАН. – Чтобы ускорить окрашивание, их добавляют в избытке, поэтому в клетке накапливаются свободные флуорофоры. Они создают нежелательное фоновое свечение, при котором шумы «перекрывают» полезные сигналы. Также перед съёмкой приходится дополнительно отмывать клетки. Это увеличивает время окрашивания, и потому такие метки не подходят для изучения быстрых процессов. Например, для исследования перестройки цитоскелета – клеточного каркаса клетки».
Избежать этих проблем помогают флуорогенные красители, которые начинают работать не в растворителях, как это принято в химии, а в комплексе с определённой молекулой.
В новой работе сотрудники Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН, Нижегородской государственной медицинской академии и Медицинского университета им. Н.И. Пирогова совместно с испанскими коллегами из Центра геномной регуляции создали пары «флуороген-белок» для маркировки белка в живых клетках. С помощью таких «дуэтов» исследователи продлили время свечения белка. Свет испускается дольше за счёт непрерывного обмена флуорогенных красителей, которые взаимодействуют с генетически кодированными белковыми метками. Отобранные флуорогены быстро проникают в живые клетки и быстро окрашивают «цель». Разработанные пары «флуороген-белок» оказались очень удобны в флуоресцентной микроскопии сверхвысокого разрешения, которая основана на регистрации «вспышек» в молекулах флуоресцентных красителей.
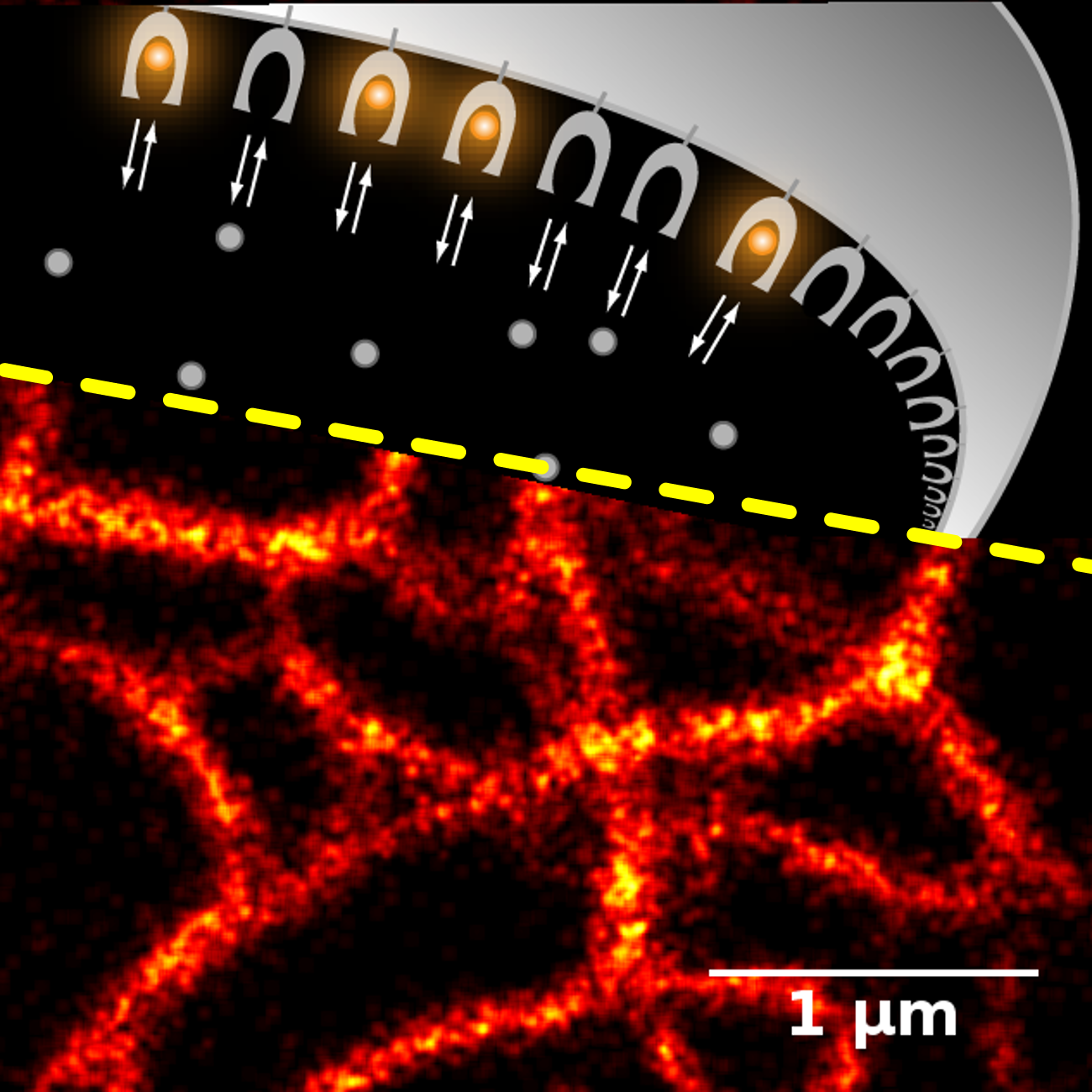
Сверху: молекулы флуорогена, испускающих свет молекул (серые и оранжевые кружки), начинают светиться в комплексе со специальным белком (генетически кодированной меткой). Постоянная замена испорченных молекул флуорогена на новые защищает от выгорания под действием сильного света. Момент объединения молекулы и белка виден в микроскопе как вспышка. Снизу: анализ множества таких вспышек можно использовать для реконструкции изображения сверхвысокого разрешения (здесь – часть цитоскелета).
«При разработке новой системы мечения мы использовали методы компьютерного моделирования, чтобы понять, как будет взаимодействовать молекула и белок, и химический синтез библиотеки флуорогенов, – продолжает Александр. – В России многие виды микроскопии недоступны. Но мы решили эту проблему благодаря участию в исследовании зарубежных коллег».
Как говорят авторы работы, новый метод на основе флуорогенных красителей значительно упростит окрашивание клеток и позволит учёным использовать более сложный экспериментальный дизайн в своих исследованиях.
(автор: Надежда Куликова)
1 сентября 2017 года

