Пресс-центр / новости / Наука /
Рецептор с «нетрадиционной» ориентацией
Тирозинкиназные рецепторы играют ключевую роль в развитии и жизнедеятельности организма. Они являются регуляторами таких процессов как пролиферация и дифференцировка клеток, клеточная миграция и метаболизм, а также участвуют в контроле клеточного цикла. До недавнего момента было известно, что все лиганды этих рецепторов являются пептидами или небольшими белками. Однако в недавно проведенном исследовании коллективом сотрудников ИБХ РАН под руководством доктора хим. наук. Александра Петренко был обнаружен тирозинкиназный рецептор, выполняющий роль сенсора слабощелочной среды, то есть — реагирующий на увеличение концентрации гидроксил-ионов снаружи клетки. Интересно, что до настоящего времени этот рецептор считался «сиротским» и не имел «своего» лиганда.
До настоящего момента считалось общепринятым, что для активации тирозинкиназных рецепторов (которых в организме человека известно 58, с подразделением на 20 семейств — см. рис. 1) необходимы многоточечные взаимодействия между рецептором и его лигандом белково-пептидной природы [1]. Лиганд, связавшись с рецептором, вызывает его димеризацию и активацию, приводящие к аутофосфорилированию внутриклеточной части рецептора. Исключением является семейство рецептора инсулина, члены которого предимеризованы с помощью дисульфидных мостиков, а их взаимодействие с лигандом вызывает аллостерические изменения внутриклеточных доменов. Это семейство включает в себя рецепторы инсулина и инсулиноподобного фактора роста, а также инсулин рецептор-подобный рецептор (ИРР), который ранее считался «сиротским» (то есть, его природный лиганд не был известен). ИРР был открыт и клонирован в 1989 году, и с тех пор многие лаборатории и биофармацевтические компании мира безуспешно пытались определить его биологическую функцию и найти природный лиганд-активатор.
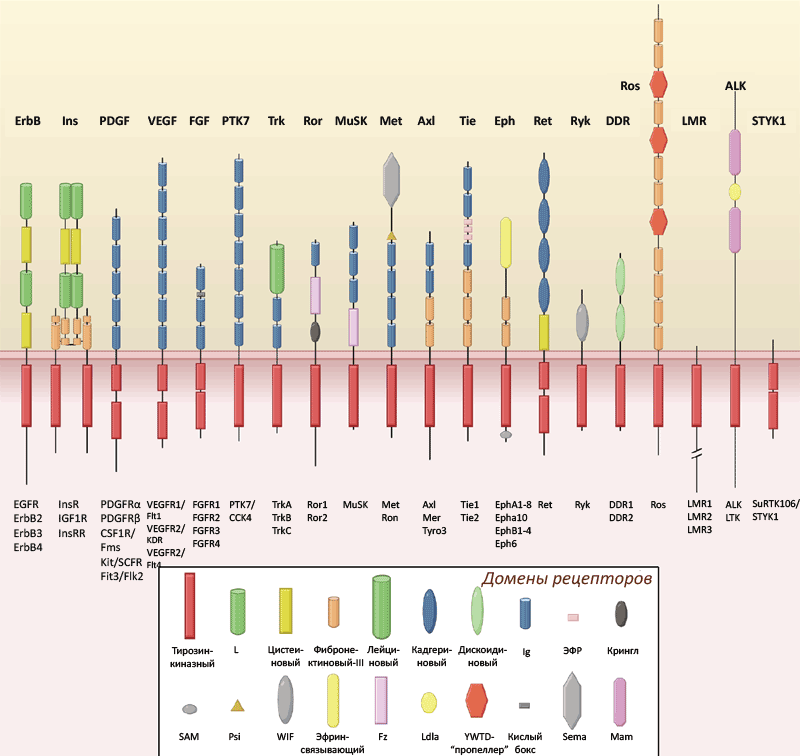
Схема 1.Структура оксилюциферина Fridericia и схема реакции биолюминесценции. [3].
В недавно завершенном исследовании коллективу российских ученых совместно с коллегами из Франции и Италии удалось найти активатор ИРР и доказать, что данный тирозинкиназный рецептор является сенсором слабощелочной среды [2], регулирующим удаление избыточной щелочи из организма. Такое защелачивание внутренних сред организма, называемое алкалозом, может происходить как при особых диетах (в частности молочной и вегетарианской), так и вследствие инфекционных и соматических заболеваний и нарушения дыхания. Некомпенсированный патологический алкалоз представляет непосредственную угрозу жизни. Проведенные исследования показали, что ИРР является рН-зависимым регулятором физиологической компенсации алкалоза и важным, ранее не описанным компонентом системы поддержания кислотно-щелочного равновесия в организме.
В ключевых экспериментах, проведенных в Лаборатории клеточной биологии рецепторов Института биоорганической химии РАН кандидатом физ.-мат. наук Игорем Деевым, было показано, что активация ИРР гидроксил-анионами имеет все характерные признаки лиганд-рецепторного взаимодействия. Активация IRR щелочным рН специфична, так как ближайшие гомологи рецепторы инсулина и инсулиноподобного фактора роста, а также рецептор эпидермального фактора роста не реагируют на изменение рН. Активация ИРР гидроксилами дозозависима, с выраженной положительной кооперативностью, — видимо, в ответ на взаимодействие с гидроксилами, в молекуле рецептора происходят существенные конформационные изменения. Эксперименты, проведенные совместно с коллективом сотрудников Института Цитологии РАН (рук. академик Никольский), показали, что фосфорилирование ИРР запускает внутриклеточный сигнальный каскад, сходный с клеточным ответом на инсулин (рис. 2). Сотрудниками Лаборатории моделирования биомолекулярных систем ИБХ (рук. профессор Роман Ефремов) были вычислены основные домены внеклеточной части рецептора, отвечающие за его активацию.
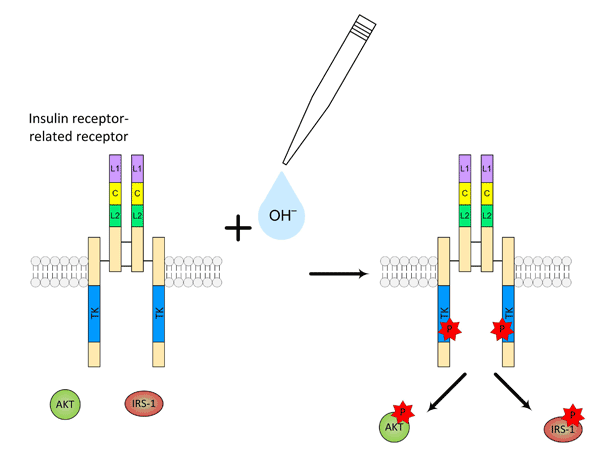
Рисунок 2. Активация рецептора ИРР под действием щелочного рН и фосфорилирование белков внутриклеточного сигнального каскада IRS-1 и AKT.
Для доказательства физиологической роли ИРР в лабораторном питомнике животных Филиала ИБХ в Пущино была получена линия мышей с нокаутированным («отключенным») геном ИРР. Совместные эксперименты сотрудников Лаборатории биологических испытаний ИБХ (рук. Аркадий Мурашев) с коллегами из Франции (проф. Доминик Эладари) и Италии (проф. Еуджинио Бертелли), проведенные на нокаутных мышах, показали, что у них отсутствует нормальный компенсационный ответ на экспериментально-индуцированный алкалоз, выраженный в недостаточном удалении избыточного бикарбоната почками.
Важно отметить, что IRR активируется при рН более 7,9. В современной физиологии такая величина считается за гранью физиологических значений гомеостаза, однако истинные кислотно-щелочные параметры многих жидкостей в организме остаются мало изученными. Интересно, что в отличие от гомологичных рецепторов инсулина и инсулиноподобного фактора роста, присутствующих практически во всех органах и тканях, экспрессия IRR ограничена почками, желудком и поджелудочной железой. Именно в этих органах происходит активная секреция оснований в виде бикарбоната, а омывающие их жидкости могут иметь существенно щелочную реакцию.
На данный момент IRR представляет собой уникальный пример в области фармакологии и физиологии, так как до этого не было известно рецепторных сенсоров щелочного рН (однако известны мембранные каналы, чувствительные к щелочному или кислому рН). Идентификация IRR в качестве щелочного сенсора, по всей видимости, приведет к пересмотру многих общепринятых взглядов на регуляцию кислотно-щелочного равновесия в организме.
Расширенная версия этого пресс-релиза опубликована на «биомолекуле».
-
Schlessinger J. (2000). Cell signaling by receptor tyrosine kinases. Cell 103,
211–225; -
Deyev I.E., Sohet F., Vassilenko K.P., Serova O.V., Popova N.V., Zozulya S.A., Burova E.B., Houillier P., Rzhevsky D.I., Berchatova A.A., Murashev A.N., Chugunov A.O., Efremov R.G., Nikol’sky N.N., Bertelli E., Eladari D., Petrenko A.G. (2011). Insulin receptor-related receptor as an extracellular alkali sensor. Cell. Metab. 13,
679–689; -
Lemmon M.A., Schlessinger J. (2010). Cell signaling by receptor tyrosine kinases. Cell 141,
1117–1134.
10 июня 2011 года

