Пресс-центр / новости / Наука /
Прорывная технология российских ученых для мировой наномедицины
Коллаборация ученых из Института биоорганической химии им. М. М. Шемякина и Ю. А. Овчинникова РАН, Московского физико-технического института и Института общей физики им. А. М. Прохорова РАН разработала революционную технологию, которая решает ключевую проблему, десятилетиями препятствовавшую внедрению в клиническую практику новейших лекарств. Работа опубликована в одном из самых авторитетных научных журналов в области биомедицины — Nature Biomedical Engineering и отмечена отдельным обзором в разделе News and Views.
Развитие медицинской химии с конца XIX века определило переход традиционной медицины к лекарствам на основе строго определенных химических молекул. Хотя данной парадигме уже около 150 лет, к ней относится абсолютное большинство современных лекарств. Как правило, используемые активные молекулы выполняют лишь простую задачу — активируют или деактивируют какой-либо рецептор в организме.
В то же время, с конца 1970-х множество лабораторий трудятся над созданием лекарств следующего поколения, которые производят сразу несколько сложных функций: например, точно идентифицируют раковые клетки по множеству параметров, сообщают о локализации опухоли врачу, а затем убивают патогенные клетки токсинами и нагреванием, чтобы не оставить в организме пациента ни одной, из которой опухоль может вновь возродиться. Все эти задачи не может выполнить одна молекула, а потому требуется создать супрамолекулярную (надмолекулярную) структуру, или «наночастицу».
Однако несмотря на колоссальное количество созданных наноматериалов, до клинического применения дошли только их простейшие узкоспециализированные варианты.
Ключевая проблема применения терапевтических наночастиц кроется в удивительной эффективности нашей иммунной системы. За длительный период эволюции организм человека научился очень хорошо бороться с чужеродными наноматериалами — будь то вирусы или частицы дыма.
При введении разумных доз большинства искусственно созданных наночастиц в кровоток клетки иммунной системы поглощают их за считанные минуты или даже десятки секунд! Соответственно, какими бы функциональными ни были вводимые лекарства, большая часть дозы просто не успеет встретиться со своей мишенью, лишь будет воздействовать (как правило, токсично) на здоровые ткани организма.
В своей публикации российские исследователи под руководством Максима Никитина, заведующего Лабораторией нанобиотехнологий МФТИ, предложили абсолютно новаторскую универсальную технологию, которая позволяет существенно продлить время циркуляции и увеличить терапевтическую активность различных наноагентов без необходимости какой-либо их модификации.
Ученые воспользовались тем фактом, что иммунная система непрерывно выводит из кровотока отработавшие свой срок «состарившиеся» эритроциты (красные кровяные клетки) — у человека около 1% эритроцитов в день.

Максим Никитин в лаборатории
«Мы предположили, что если заставить организм немного усилить данный естественный процесс, то иммунная система может “увлечься” удалением эритроцитов и будет уделять меньше внимания терапевтическим наночастицам. Более того, мы хотели обхитрить иммунную систему максимально мягко, в идеале — средствами самого организма, а не искусственно синтезированными веществами», — говорит Максим Никитин.
И элегантное решение было найдено: ученые ввели мышам антитела (молекулы, являющиеся основой иммунной системы млекопитающих, которые помогают распознавать, что надо удалить из организма), которые специфично связываются с эритроцитами. Гипотеза оказалась верной и крайне эффективной. Небольшая доза антител (1,25 мг/кг) позволила достичь продления циркуляции наночастиц в кровотоке в десятки раз. При этом антитела вызывали лишь легкую анемию — падение гематокрита (количества эритроцитов в крови) на 5%.
Исследователи показали, что данный подход, названный цитоблокадой мононуклеарной фагоцитарной системы, универсален с точки зрения наночастиц. Он продлевает циркуляцию и маленьких квантовых точек размером 8 нанометров, и 100-нанометровых частиц, и больших микронных частиц, и даже наиболее продвинутых наноагентов, допущенных к введению человеку, — стелс-липосом (агентов с полимерным покрытием, маскирующим их от иммунной системы). В то же время цитоблокада не снижает способность организма бороться с подпадающими в кровоток бактериями (которые тоже являются микрочастицами), причем как в условиях малой дозы бактерий, так и в условиях сепсиса.
Важно, что данное решение проблемы короткой циркуляции наночастиц, которая десятилетиями сдерживала внедрение в клиническую практику лекарств следующего поколения, позволяет продлевать время циркуляции в кровотоке биомедицинских наноматериалов без какой-либо химической модификации. Таким образом, технология дает «зеленый свет» внедрению самых функциональных и передовых агентов, способных реализовывать новые подходы терапии, ранее принципиально недоступные в живых организмах.
Новая технология открывает возможность широкого ряда применений. Например, в одной серии экспериментов ученые кардинально улучшили так называемую «активную» доставку наноагентов к клеткам-мишеням. При таком способе доставки наночастица идентифицирует клетку-мишень с помощью специфической молекулы, например, антитела против клеточного рецептора CD4, который присутствует на T-клетках крови. Доставка лекарств к этим клеткам может быть полезна для лечения ряда аутоиммунных и других заболеваний. Если мышам за 12 часов до введения наночастиц вводили антитела против эритроцитов, то частицы циркулировали не 3–5 минут, как обычно, а уже около часа. При этом они не просто прекрасно связывались с мишенями, а показали эффективность связывания, не уступающую достигнутой in vitro. Этот эксперимент наглядно показал, что разработанный метод цитоблокады обладает огромным потенциалом, поскольку не просто улучшает эффективность наноагента, но и позволяет вводить в практику даже те агенты, которые хорошо зарекомендовали себя в испытаниях на клетках (в пробирке), но были совершенно неработоспособны в живом организме.
Далее была продемонстрирована эффективность метода для онкотерапии. Цитоблокада значительно (до 23 раз) улучшила магнитно-опосредованную доставку наночастиц в опухоль (Рис. 1). Данный способ использует магнитное поле для дополнительного фокусирования и удержания магнитных лекарственных агентов в опухоли, тем самым снижая системную токсичность. Это один из вариантов направленной доставки лекарств, который доступен лишь наночастицам и недоступен молекулам. Кроме того, разработанный метод позволил провести эффективную терапию меланомы с помощью липосом, нагруженных магнетитом и доксорубицином (химиотерапевтическим препаратом), которые без введения антиэритроцитных антител были совершенно неработоспособны. Улучшение магнитной доставки было продемонстрировано для пяти видов опухолей различной природы: от меланомы до рака молочной железы.
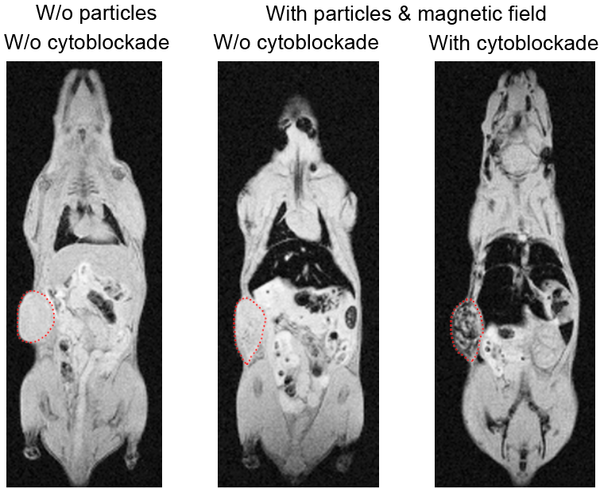
Рис. 1. Сравнение между доставкой магнитно-опосредованной доставкой наночастиц в опухоль мышей с использованием цитоблокирующей технологии (справа) и без нее (в центре); Контроль представлен слева. Опухоль обведена красным пунктиром, затемнения указывают на большую концентрацию наночастиц в опухоли
«Мы наблюдали повышение эффективности доставки нанопрепаратов на каждом типе рака, с которым пробовали делать эксперименты. Особенно важно, что наш метод работал и на образцах опухолей человека, которые прививались мышам», — говорит Иван Зелепукин, соавтор статьи, младший научный сотрудник Лаборатории молекулярной иммунологии ИБХ РАН и МФТИ.
Важно отметить, что разработанная технология обеспечивала улучшение терапии, в том числе для коммерчески доступного и допущенного к использованию на человеке липосомального препарата. Таким образом, цитоблокада не только открывает недоступные ранее возможности для новых методов лечения, но и позволяет улучшать существующие.
Авторы отмечают, что повышение эффективности частиц в организме четко коррелировало с продлением их циркуляции в кровотоке. Такую корреляцию удалось подтвердить благодаря собственной уникальной разработке ученых, а именно — высокочувствительного метода регистрации магнитных частиц MPQ (от англ. magnetic particle quantification). Он позволяет неинвазивно (то есть без забора крови) регистрировать кинетику выведения частиц из кровотока. «Данный метод не просто позволил измерять содержание частиц в кровотоке в реальном времени, но и вообще дал возможность провести данное исследование. Для работы потребовалось измерить такое гигантское количество кинетик, что другие известные методы в принципе не позволили бы это проделать в разумные сроки», — комментирует Пётр Никитин, соавтор исследования, заведующий лабораторией биофотоники ИОФ РАН.

Иван Зелепукин синтезирует наночастицы для терапии
Разработанная технология чрезвычайно перспективна для трансляции в клинические применения: в настоящее время антиэритроцитные антитела, так называемые анти-D антитела против резус-фактора, допущены для введения человеку и широко используются в клинике сами по себе — для лечения иммунотромбоцитопении, а также профилактики резус-конфликта.
«Безусловно, сочетанное действие существующих или новых противоэритроцитных антител с противоопухолевыми и иными препаратами должно пройти тщательную проверку клиническими испытаниями. Однако мы крайне оптимистично смотрим на данную технологию и ее применение для лечения тяжелых заболеваний, где требуется направленная доставка лекарств, включая рак. Теперь, когда этап публикации этого сложного семилетнего исследования завершен, мы просто обязаны приложить все возможные усилия для трансляции данной технологии в мировую клиническую практику. Поэтому, в частности, мы очень ищем активных коллег, желающих присоединиться к нашей команде, а также коллабораторов», — говорит Максим Никитин.
Особенность новой разработки заключается в том, что ее тестирование можно начать в ближайшее время за счет использования комбинации уже допущенных препаратов, упомянутых выше. Но даже более важно то, что в силу концептуальных преимуществ эта платформенная технология может оказаться более результативной, чем метод «ПЭГилирования», который заключается в маскировании поверхности частиц оболочкой из полиэтиленгликоля и является основой многомиллиардной индустрии «долгоциркулирующих лекарств», список которых насчитывает десятки клинически одобренных препаратов.
Авторы исследования полагают, что разработка открывает двери для широкого внедрения самых современных наноагентов с основным упором на функциональность, а не на «маскирующую» оболочку. Новые биомедицинские наноматериалы, созданные в соответствии с самыми смелыми идеями в области наук о материалах, могут быть оперативно внедрены в исследовательскую практику in vivo, а затем быстро усовершенствованы для клинического использования.
Отдельные аспекты работы были выполнены при поддержке Российского научного фонда.
16 июля 2020 года
Источник: https://mipt.ru/news/proryvnaya_tekhnologiya_rossiyskikh_uchenykh_dlya_mirovoy_nanomeditsiny




