Пресс-центр / новости / Наука /
Первая кристаллическая структура бактериальной олигопептидазы В в переходном состоянии: роль модификации шарнирной области и спермина
Олигопептидазы В (OpB) представляет собой двухдоменные сериновые пептидазы, имеющие трипсиноподобную субстратную специфичность. OpB принадлежат к семейству пролилолигопептидаз (POP) и встречаются только у бактерий и простейших. Известно, что OpB являются факторами патогенеза протозойных инфекций и защищают бактериальные клетки от ряда антимикробных пептидов. Тем не менее, они являются наименее изученными представителями POP, особенно это касается бактериальных OpB, для которых до недавнего времени полностью отсутствовала структурная информация. Сотрудниками ИБХ РАН совместно с сотрудниками НИЦ Курчатовский институт и ИБХ НАН Беларуси удалось получить кристаллические структуры бактериальной OpB из Serratia proteomaculans (PSP) с модифицированной шарнирной областью.
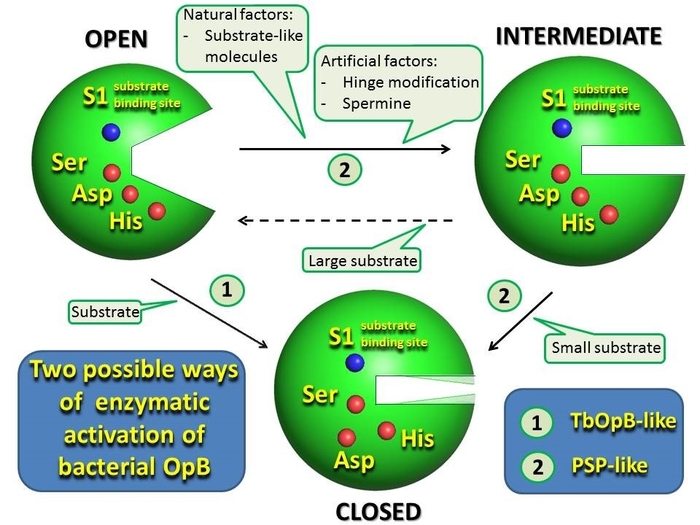
Особенностью OpB и других РОР является наличие регуляторного домена, который ограничивает доступ к активному центру, находящемуся в полости между доменами, субстратов с размерами более 3 кДа. Домены соединены шарнирной областью, что позволяет пептидазам принимать две конформации: закрытую (активную) и открытую (не активную). В закрытой конформации, каталитический и регуляторный домены, а также остатки каталитической триады сближены друг с другом, а в открытой разобщены, что препятствует катализу, но способствует доступу субстратов к активному центру. Открытая и закрытая конформации были обнаружены в структурах OpB из Trypanosoma Brucei (TbOpB) и бактериальных POP, закристаллизованных в свободной форме и в комплексах с необратимыми ингибиторами, соответственно.
В первой кристаллической структуре бактериальной OpB была обнаружена необычная конформация, характеризующейся сближением доменов без сближения остатков каталитической триады, и предположительно являющаяся переходной между открытой и закрытой конформациями. Кроме того, в междоменной полости PSP присутствовали молекулы спермина, который вместе с модификацией шарнирной области способствовал кристаллизации.
Влияние модификации шарнирной области и спермина на конформационное состояние PSP в растворе было изучено методом малоуглового рассеяния рентгеновских лучей (МУРР), который показал, что в растворе фермент дикого типа имеет открытую конформацию, а переходная конформация связана с добавлением спермина. Однако, в растворе фермента с модифицированной шарнирной областью даже в отсутствии спермина выявлялась фракция молекул в переходном состоянии.
Поскольку состав цитоплазмы значительно богаче чем буфернo-солевые растворы, используемые в биохимических и структурных исследованиях, то обнаруженное в работе переходное состояние, скорее всего широко распространено in vivo, а наблюдаемый спермин-зависимый конформационный переход воспроизводит поведение OpB в бактериальных клетках. Двухступенчатая каталитическая активация, при которой сближение доменов предшествует формированию рабочей конфигурации каталитической триады, может как сосуществовать с прямым переходом из открытого в закрытое состояние, который был предложен для TbOpB и бактериальных POP, так и быть основным путём каталитической активации бактериальных OpB.
Работа выполнена при финансовой поддержке Российского научного фонда, грант № 21-74-20154 и опубликована в журнале Biology.
27 октября 2021 года


