Лаборатория биофармацевтических технологий
|
Руководитель: Есипов Роман Станиславович |
Основными направлениями работ сотрудников лаборатории биофармацевтических технологий являются разработка фундаментальных и прикладных аспектов биотехнологии и внедрение результатов в производство биофармацевтических препаратов. В лаборатории осуществляется полный цикл работ в области генной инженерии и белковой химии: от выбора стратегии клонирования индивидуального гена и его химико-ферментативного синтеза до разработки метода выделения, очистки, полной физико-химической идентификации и исследования биологической активности, масштабирования экспрессии и стадии ферментации, а также создания лабораторных и опытно-промышленных регламентов, которые реализуются совместно с Опытным биотехнологическим производством. Особое внимание уделяется разработке биотехнологий получения биологически активных фармацевтических субстанций (АФС) и созданию готовых лекарственных средств (ГЛС) препаратов на основе рекомбинантных белков и пептидов, на базе опытного биотехнологического производства ИБХ РАН.
Лаборатория, входящая в состав отдела биотехнологии, успешно принимает участие в государственных программах: «Фарма 2020», Федеральной космической программе России, грантах Российского Фонда Науки и Российского Фонда Фундаментальных Исследований. Сотрудники лаборатории неоднократные победители конкурса молодых ученых на Московской международной конференции «БИОТЕХНОЛОГИЯ и МЕДИЦИНА», «УМНИК».
Сотрудники лаборатории обладают большим опытом в создании и дальнейшей верификации широкого круга рекомбинантных препаратов, получаемых в том числе и с помощью технологий белкового сплайсинга. Совместная работа сотрудников лаборатории с опытным биотехнологическим производством ИБХ РАН позволила в кратчайшие сроки организовать получение опытных партий целого ряда потенциальных лекарственных препаратов в рамках государственных контрактов Минпромторга и Минобрнауки для проведения доклинических исследований.
Большое внимание в лаборатории уделяется работе со школьниками, студентами и аспирантами профильных учебных заведений. Заяц Евгений Андреевич, прежде чем стать аспирантом и сотрудником лаборатории, успешно завершил магистратуру Института тонких химических технологий Московского технологического университета (МТУ). В годы студенчества он активно принимал участие в нескольких интеллектуальных турнирах биологической направленности всероссийского и международного уровня в составе команды «БиоТех» МИТХТ : IV открытом всероссийском студенческом командном соревновании «Биотурнир 2017» в г. Пущино (II место в командном зачете), Международной биологической универсиаде МГУ 2017 (командный диплом II степени), III студенческом биологическом турнире МГУ 2018 (командный диплом III степени). Евгений также стал победителем в личном первенстве, получив диплом II степени.
27 октября 2016 года сотрудники Института биоорганической химии РАН провели экскурсию для участников профориентационного проекта библиотеки им. Н.А. Некрасова «Завтра»
Одним из главных достижений лаборатории биофармацевтических технологий совместно с опытным биотехнологическим производством ИБХ является разработка и внедрение отечественной технологии производства активной фармацевтический субстанции (АФС) генно-инженерного глюкагона человека (руководитель – акад. А.И. Мирошников). Реализация проекта была осуществлена в 2012-2015 гг. при поддержке Министерства промышленности и торговли Российской Федерации. Получение АФС привело к разработке готовой лекарственной формы глюкагона – «ГЛЮКОРАН» (глюкагон рекомбинантный, человеческий генноинженерный, лиофилизат для приготовления раствора для инъекций 1 МЕ/мг). Завершение этого проекта позволило подготовить регистрационное досье на производство на базе ОБП ИБХ АФС и лекарственных форм генно-инженерного глюкагона человека.
За время существования лаборатории, под руководством Есипова Романа Станиславовича, защищено 4 кандидатские и более 25 бакалаврских и магистерских работ.
Фото с защиты кандидатской диссертации Макарова Д.А.

СМИ о деятельности лаборатории:
1. Будет видно! Новый препарат предотвратит потерю зрения. Поиск. Еженедельная газета научного сообщества. №14 (1608) 13 апреля 2020. Стр. 12 – 13. https://www.poisknews.ru/magazine/budet-vidno/
2. Ученые разработали препарат, предотвращающий снижение зрения у больных сахарным диабетом. Центры компетенции НТИ. ТАСС Наука. 11 марта 2020 г. https://nauka.tass.ru/nauka/7947825
3. Служит людям… бактерия. Газета Юго-Западного административного округа Москвы. № 31 (213). 30 августа 2017 г. Стр. 15.
Партнеры:
- АО «Р-Фарм»
- Проф. И.П. Куранова – зав. лаборатории кристаллографии белков Институт кристаллографии им. Шубникова РАН
- К.б.н. С.П. Домогатский – рук. группа инженерной иммунологии ФГБУ «Российский кардиологический научно-производственный комплекс» Минздрав РФ Институт экспериментальной кардиологии
- Проф. В.С. Акопян – зав. кафедрой офтальмологии Факультет фундаментальной медицины МГУ
- Проф. М.А.Владимирский – заведующим лаборатории иммунологических исследований и молекулярной диагностики туберкулёза. Научно-исследовательский Институт Физиопульманологии Московской Медицинской Академии им. Сеченова
- К.б.н. М.Л.Филиппенко – руководитель лаборатории фармакогеномики НИИ Химической биологии и фундаментальной медицины
- Д.х.н. Ю.С. Скоблов – зав. лаборатории изотопных методов анализа Институт биоорганической химии им. Академиков М.М.Шемякина и Ю.А.Овчинникова РАН
- Проф. С.Н.Михайлов – зав. лаборатории химии нуклеозидов Институт Молекулярной биологии им. Энгельгардта РАН
- Научный центр «Сигнал» (ФГУП НЦ Сигнал)
- Научно-исследовательский институт прикладной акустики (ФГУП НИИПА)

Генная инженерия и биоорганическая химия:
- Создание высокоэффективных штаммов-продуцентов белков, в том числе и ферментов, представляющих интерес, как для медицинской практики, так и для прикладного использования в биотехнологии и белковой инженерии.
- Разработка методов получения рекомбинантных белков и пептидов, том числе и с использованием процесса белкового сплайсинга, их пост-трансляционная модификация in vivo и in vitro.
- Химические и ферментативные модификации белков, в том числе и пост-трансляционные, изменяющие свойства целевых продуктов.
- Кристаллизация ферментов и создание рентгеноструктурных моделей белков. Изучение активного центра ферментов.
- Создание препаратов на основе белков и ДНК, ответственных за регенерацию тканей
Промышленная биотехнология:
Создание лабораторных и опытно-промышленных регламентов на производство субстанций рекомбинантных белков (пептидов), в том числе медицинского назначения, решение проблем масштабирования процессов ферментации, выделения и очистки.
Препараты медицинского назначения:
- Разработан биотехнологический подход получения ряда активных фармацевтических субстанций рекомбинантных полипептидов на основе гибридных белков, содержащих тиоредоксин А, целевой полипептид и сайт расщепления гибридного белка TEV протеиназой.
- Разработан интеин-опосредованный биотехнологический подход получения ряда активных фармацевтических субстанций рекомбинантных полипептидов на основе гибридного белка, содержащего элементы белкового сплайсинга и не требующего применения специфических протеаз.
- Разработан биотехнологический способ получения рекомбинантных тимозина α1 и тимозина β4 человека, исключающий стадию химического ацетилирования пептида.
- С использованием разработанных технологических подходов созданы опытно-промышленные технологии получения активных фармацевтических субстанций следующих рекомбинантных полипептидов: тимозин α1, тимозин β4 (Тиморан), глюкагон (Глюкоран), тумстатин (Тумастин), аналоги гирудина (Лепирудин и Дезирудин), эндостатин, сиалированный оксинтомодулин (Оксилонг), модифицированный фрагмент фактора дифференцировки пигментного эпителия (Пигостин), эпидермальный фактор роста, окситоцин, анальгетик АРНС-3 (Пептальгин), анальгетик РТ-1 (Пунальгин).
- На основе АФС созданы лекарственные средства: «Глюкоран», «Оксилонг», «Пигостин», «Пептальгин», «Тиморан», «Пунальгин».
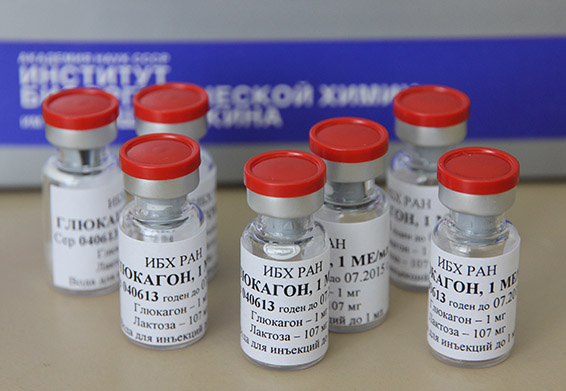
Пример активной фармацевтической субстанции, полученной для проведения доклинических испытаний.
- Для всех созданных технологий разработаны методы технологического контроля и анализа конечного продукта, включая тестирование биологической активности.
- Разработана технологическая документация (опытно-промышленные технологические регламенты).
- Доказана высокая специфическая биологическая активность на клеточных и животных моделях препаратов «Тиморан», «Глюкоран», «Оксилонг», «Пигостин», «Тумстатин», «Лепирудин», «Дезирудин», «Пептальгин» и «Пунальгин».
- Разработаны лабораторные регламенты получения серии цитокинов, в том числе и в пегилированной форме: интерлейкина 2, интерлейкина 3, инетрлейкин 4, интерлейкина 15, интерлейкин 18, интерферона альфа-2а, интерферона альфа-2в.
Противотуберкулезная тематика:
- Получены штамм-продуценты таргетных ферментов Mycobacterium tuberculosis, жизненно важных для деятельности микобактерии и разработаны методы очистки этих ферментов:
- кислая фосфатаза
- фосфопантетеин-аденилилтрансфераза
- Ser/Thr-специфичная протеинкиназа
- имидазол-глицерол-фосфатдегидратаза
- аспартат аминотрасфераза AspC
- кетол-кислотная редуктоизомераза
2. Методом встречной диффузии в капиллярах получены кристаллы микобактериальной фосфопантетеин-аденилилтрансферазы комплексе с субстратами – АТФ, коэнзимомА и с дефосфокоэнзимомА.

Кристаллы фосфопантетеин-аденилилтрансферазы M.tuberculosis
3. Методом рентгеноструктурного анализа решена кристаллическая структура микобактериальной фосфопантетеин-аденилилтрансферазы комплексе с субстратами:
-фосфопантетеин-аденилилтрансферазы Mycobacterium tuberculosis с АТФ (3UC5)
Timofeev, V., Smirnova, E., Chupova, L., Esipov, R., Kuranova, I. X-ray study of the conformational changes in the molecule of phosphopantetheine adenylyltransferase from Mycobacterium tuberculosis during the catalyzed reaction. (2012) Acta Crystallogr D Biol Crystallogr, 68: 1660-1670;
-фосфопантетеин-аденилилтрансферазы Mycobacterium tuberculosis с коэнзимом А (3LCJ)
Timofeev, V.I., Smirnova, E.A., Chupova, L.A., Esipov, R.S., Kuranova, I.P. Preparation of the Crystal Complex of Phosphopantetheine Adenylyltransferase from Mycobacterium tuberculosis with Coenzyme A and Investigation of Its Three-Dimensional Structure at 2.1-A frame Resolution. (2010) Crystallogr Rep, 55: 1050-1059;
- фосфопантетеин-аденилилтрансферазы Mycobacterium tuberculosis с DPCoA (4R0N)
Timofeev, V.I., Smirnova, E.A., Chupova, L.A., Esipov, R.S., Kuranova, I.P. X-ray Study of the Conformational Changes in the Molecule of Phosphopantetheine Adenylyltransferase From Mycobacterium Tuberculosis During the Catalyzed Reaction. (2012) Acta Crystallogr D Biol Crystallogr, 68(Pt 12): 1660-70.
4. Создан штамм-продуцент белков культурального фильтрата микобактерий туберкулеза, в семейство которых входит секреторные антигены ESAT-6 и CFP10. Разработаны методы выделения гибридного белка cfp10-esat6.
Антитромбиновая тематика (антикоагулянты):
- Разработан интеин-опосредованный биотехнологический подход получения рекомбинантных аналогов ряда высокоспецифичных прямых ингибиторов тромбина из кровососущих организмов: аналогов гирудина из медицинской пиявки H. medicinalis, анофелина из малярийного комара Anopheles albimanus, гемадина из Haemadipsa sylvestris и вариегина из тропического клеща Amblyomma variegatum, не требующий применения специфических протеаз.
- Проведено комплексное исследование антитромботической активности рекомбинантных антикоагулянтов, включающее: определение антитромботической активности in vitro с помощью амидолитического теста; влияние препаратов на изменение времен свертывания плазмы крови человека (тромбинового, протромбинового и активированного частичного тромбопластинового времен); установлены фармакодинамические эффекты при внутривенном введении мышам линии CD-1. Для исследования специфической антитромботической активности in vivo были использованы модели хвостового кровотечения и венозного тромбоза на фоне гиперкоагуляции на крысах Sprague Dawley. В качестве препаратов сравнения использовали рекомбинантный гирудин-1 (дезирудин), нефракционированный гепарин и дабигатрана этексилат (Pradaxa, Boehringer Ingelheim, Германия).
Ферменты нуклеинового обмена:
-
Получены штаммы-продуценты пуриннуклеозид фосфорилазы T.thermophiles, фосфорибозилпирофосфат синтетазы II T.thermophiles, аденинфосфорибозилтрансферазы T.thermophiles, рибокиназы T.sp., рибомутазы T.thermophiles, гипоксантин-гуанин фосфорибозилтрансферазы T.thermophiles, пуриннуклеотид фосфорилазы E.coli, фосфорибозилпирофосфат синтетазы E.coli, тимидин фосфорилазы E.coli, уридин фосфорилазы E.coli, уридин фосфорилазы Salmonella typhimurium, аденозин дезаминазы E.coli, рибокиназы и рибомутазы E.coli.
-
Разработаны эффективные методы наработки ферментов нуклеинового обмена в промышленных масштабах.
-
Предложена новая стратегия биосинтеза биологически важных нуклеозидов, которая состоит в мультиферментном каскадном превращении D-пентоз в пуриновые нуклеозиды. Каскадный синтез включает последовательное превращение в «одной колбе» D-пентоз в 5-фосфаты под действием рибокиназы, из которой затем синтезируется 1-фосфат пептоза под действием рибомутазы, и затем конденсация последних с гетероциклическими основаниями в присутствии пуриновых и пиримидиновых нуклеозид фосфорилаз дает желаемые нуклеозиды.
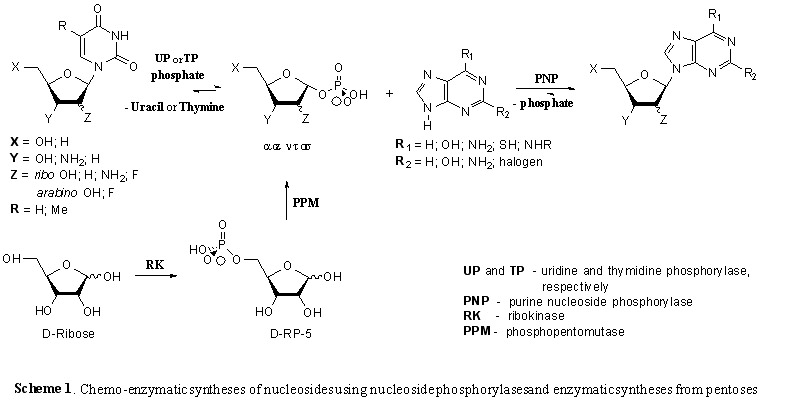
4. Предложена новая стратегия биосинтеза биологически важных нуклеотидов, которая состоит в мультиферментном каскадном превращении D-пентоз в пуриновые нуклеотиды. Каскадный синтез включает последовательное превращение в «одной колбе» D-пентоз в 5-фосфаты под действием рибокиназы, из которых затем синтезируются 5-фосфо-α-D-пентофуранозо-1-пирофосфаты под действием фосфорибозилпирофосфатсинтетазы (PRPP-cинтетазы), конденсация последних с гетероциклическими пуриновыми основаниям в присутствии аденинфосфорибозилтрансферазы (APR-трансферазы) дает желаемые нуклеотиды.
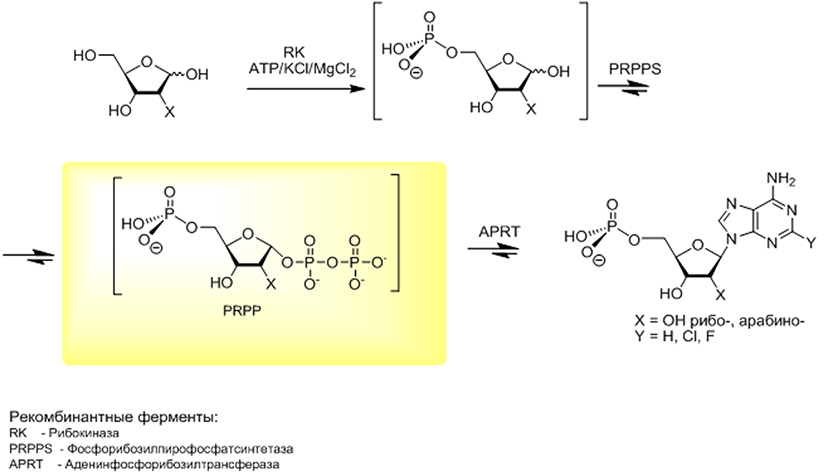
5. Методом встречной диффузии в капиллярах получены кристаллы рибокиназы E.coli и T.thermophiles, PRPP-cинтетазы и APR-трансферазы E.coli и T.thermophiles, пуриннуклеозид фосфорилазы E.coli и T.thermophiles, тимидинфосфорилазы E.coli в том числе и с ингибиторами и субстратами
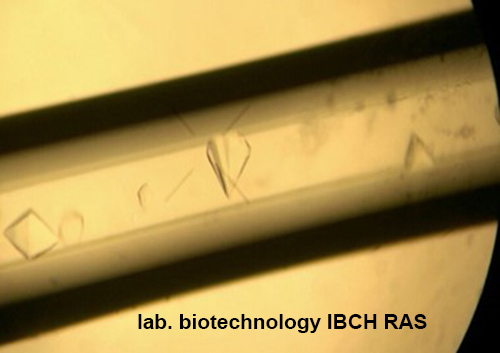
Кристалл фосфорибозил-пирофосфатсинтетазы из Thermus thermophilus HB27.

Кристалл пуриннуклеозидфосфорилазы E.coli.
6. Определены субстратные свойства целого ряда ферментов нуклеинового обмена.
7. Методом рентгеноструктурного анализа решены кристаллические структуры следующих ферментов, в том числе с ингибиторами и субстратами:
- рибокиназы из Thermus sp.
Esipov RS, Timofeev VI, Sinitsyna EV, Tuzova ES, Esipova LV, Kostromina MA, Kuranova IP, Miroshnikov AI. Three-Dimensional Structure of Recombinant Adenine Phosphoribosyltransferase from Thermophilic Bacterial Strain Thermus thermophilus HB27. (2018) Russ. J. Bioorganic Chem. 44 (5): 504–510;
Timofeev, V.I., Sinitsyna, E.V., Kostromina, M.A., Muravieva, T.I., Makarov, D.A., Mikheeva, O.O., Kuranova, I.P., Esipov, R.S. Crystal structure of recombinant phosphoribosylpyrophosphate synthetase 2 from Thermus thermophilus HB27 complexed with ADP and sulfate ions. (2017) Acta Crystallogr F Struct Biol Commun 73: 369-375;
Timofeev VI, Abramchik YA, Zhukhlistova NE, Muravieva TI, Esipov RS, Kuranova IP. Three-dimensional structure of E. Coli purine nucleoside phosphorylase at 0.99 Å resolution. (2016). Crystallogr report. 61 (2): 249–257;
Timofeev VI, Zhukhlistova NE, Abramchik YA, Fateev II, Kostromina MA, Muravieva TI, Esipov RS, Kuranova IP. Crystal structure of Escherichia coli purine nucleoside phosphorylase in complex with 7-deazahypoxanthine. (2018) Acta Crystallogr F Struct Biol Commun. 74(Pt 6): 355-362;
Timofeev VI, Zhukhlistova NE, Abramchik YA, Muravieva TI, Esipov RS, Kuranova IP. Crystal structure of Escherichia coli purine nucleoside phosphorylase complexed with acyclovir. (2018). Acta Crystallogr F Struct Biol Commun, 1;74(Pt 7): 402-409;
Timofeev VI, Abramchik YA, Zhukhlistova NE, Muravieva TI, Esipov RS, Kuranova IP. Three-dimensional structure of phosphoribosyl pyrophosphate synthetase from E. coli at 2.71 Å resolution. (2016). Crystallogr report. 61 (1): 44–54;
Timofeev, V., Abramchik, Y., Zhukhlistova, N., Muravieva, T., Fateev, I., Esipov, R., Kuranova, I.3'-Azidothymidine in the active site of Escherichia coli thymidine phosphorylase: the peculiarity of the binding on the basis of X-ray study. (2014) Acta Crystallogr D Biol Crystallogr 70: 1155-1165;
Timofeev VI, Abramchik YA, Fateev IV, Zhukhlistova NE, Muraveva TI, Kuranova IP, Esipov RS Three-Dimensional Structure of Thymidine Phosphorylase from E. coli in Complex with 3'-Azido-2'-Fluoro-2',3'- Dideoxyuridine. (2013). Crystallogr report. 58 (6): 842–853.
Патенты:
1. Есипов Р.С., Макаров Д. А., Степаненко В. Н., Андреев Я. А., Козлов С. А., Гришин Е. В. Рекомбинантная плазмидная ДНК pER-APHC3, кодирующая гибридный белок, способный к автокаталитическому расщеплению с образованием APHC3, штамм Eschrichia coli C3030/pER-АРНС3 продуцент указанных белков и способ получения рекомбинантного APHC3. Патент РФ № 2619170 от 18.09.2015.
2. Есипов Р.С., Макаров Д.А., Степаненко В.Н., Мирошников А.И. Ковалентный моноконьюгат капроновой кислоты с тимозином бета 4, устойчивый к деградации в токе крови, и способ его получения. Патент РФ № 2604686 от 23.11.2015.
3. Есипов Р.С., Макаров Д.А., Степаненко В.Н., Мирошников А.И. Ковалентный моноконъюгат полисиаловой кислоты с тимозином бета 4, устойчивый к деградации в токе крови, и способ его получения. Патент РФ № 2605385 от 23.11.2015.
4. Есипов Р.С., Макаров Д.А., Степаненко В.Н., Мирошников А.И. Ковалентный моноконьюгат полиэтиленгликоля с тимозином бета 4, устойчивый к деградации в токе крови, и способ его получения. Патент РФ № 2607527 от 23.11.2015.
5. Есипов Р.С., Степаненко В.Н., Макаров Д.А., Мирошников А.И. Рекомбинантная плазмидная ДНК pER-TA1GyrA-AcSer, кодирующая сериновую ацетилтрансферазу, способную in vivo ацетилировать N-концевой серин дезацетилтимозина альфа-1 и гибридный белок, способный к автокаталитическому расщеплению с образованием тимозина альфа-1 человека, штамм-продуцент Eschrichia coli C3030/pER-TA1GyrA–AcSer продуцент указанных белков и способ получения генно-инженерного тимозина альфа-1 человека. Патент РФ № 2593172 от 07.07.2016.
6. Есипов Р.С., Макаров Д.А., Степаненко В.Н., Мирошников А.И. Рекомбинантная плазмидная ДНК pER-TB4GyrA-AcSer, кодирующая сериновую ацетилтрансферазу, способную in vivo ацетилировать N-концевой серин дезацетилтимозина бета 4 и гибридный белок, способный к автокаталитическому расщеплению с образованием тимозина бета 4 человека, штамм-продуцент Eschrichia coli C3030/pER-TB4GyrA–AcSer продуцент указанных белков и способ получения генно-инженерного тимозина бета 4 человека. Патент РФ № 2592860 от 07.07.2016.
7. Есипов Р.С., Степаненко В.Н., Василевский А.А., Королькова Ю.В., Гришин Е.В. Способ получения рекомбинантного анальгетического пептида. Патент РФ на изобретение № 2571942 от 27.11.2015.
8. Есипов Р.С., Степаненко В.Н., Бейрахова К.А., Мирошников А.И., Автушенко С.С., Сурков К.Г., Романов В.Д., Генкин Д.Д. Оксинтомодулин человека, его применение. Лекарственный препарат на его основе и способ применения препарата для лечения и профилактики гипергликемии. Патент РФ на изобретение № 2524204 от 27.07.2014
9. Есипов Р.С., Степаненко В.Н., Костромина М.А., Мирошников А.И., Воробьев А.И., Юрьев А.С. Рекомбинантная плазмидная ДНК pER-Hir, кодирующая гибридный белок, способный к автокаталитическому расщеплению с образованием [Leu1, Thr2]-63-десульфатогирудина, штамм Escherichia coli ER2566/pER-Hir - продуцент указанного белка и способ получения генно-инженерного [Leu1, Thr2]-63-десульфатогирудина. Патент РФ на изобретение № 2435858 от 10.12.11.
Биофармацевтические белки и пептиды
Пептидные гормоны
- Глюкагон человека
- Интерлейкин-3 человека
- Интерлейкин-15 человека
- Окситоцин человека
- Оксинтомодулин свиньи и человека
- Проинсулин и C-пептид человека
- Tимозин α1 человека
- Tимозин β4 человека
- Эпидермальный фактор роста человека
Анти- и ангиогенные препараты
- Пигастин (фрагмент 24-57 фактора дифференцировки пигментного эпителия PEDF)
- Сосудистый фактор роста эндотелия: изоформа VEGF165b
- Сосудистый фактор роста эндотелия VEGF165
- Тумастин (фрагмент тумстатина (L69K-95) человека)
- Фрагмент эндостатина 1-49
Антитромботические препараты
- Анофелин из Anopheles albimanus
- Вариегин из Amblyomma variegatum
- Гирудин-1 из Hirudo medicinalis (дезирудин)
- [Leu1, Thr2]-гирудин-1 из Hirudo medicinalis (лепирудин)
- Гаемадин из Haemadipsa sylvestris
Антигены аллергических реакций
- Phl p I из тимофеевки луговой Phleum pretense
- Amb a 1.1 из амброзии полыннолистной Ambrosia artemisiifolia
- Bet v 1 из березы Betula pendula
- Der p 3 из клещей домашней пыли Dermatophagoides pteronyssinus
Полипептиды для медицинского применения
- Азурин из Pseudomonas aeruginosa и его фрагменты
- APCH 3 из Sebae anemone (Heteractis crispa)
- ESAT-6 и CFP10-ESAT-6
- Пуротоксин-1 из Alopecosa marikovskyi
- Циклотиды
- Эксендин-4
Ферменты нуклеинового обмена
- Из мезофильных микроорганизмов
- Аденинфосфорибозилтрансфераза E.coli
- Аденозиндезаминаза E.coli
- Пуриннуклеозидфосфорилаза E.coli
- Пуриннуклеозидфосфорилаза с мутацией Met62Val E.coli
- Рибозо-фосфатпирофосфокиназа (RPPK) E.coli
- Рибокиназа E.coli
- Тимидинфосфорилаза E.coli
- Уридинфосфорилаза E.coli
- Уридинфосфорилаза Salmonella typhimurium
- Фосфопентомутаза E.coli
- Фосфорибозилпирофосфатсинтетаза (PRPPS) E.coli
- Из термофильных микроорганизмов
- Аденинфосфорибозилтрансфераза Thermus thermophilus HB27
- Гипоксантин-гуанин фосфорибозилтрансфераза Thermus thermophilus HB27
- Пуриннуклеозидфосфорилаза I Thermus thermophilus HB27
- Пуриннуклеозидфосфорилаза II Thermus thermophilus HB27
- Рибокиназа Thermus species
- Фосфопентомутаза Thermus thermophilus HB27
- Фосфорибозилпирофосфатсинтетаза (PRPP) Thermus thermophilus HB27
Ферменты
- Протеаза вируса табаичной мозаики
- Протеаза вируса иммунодефицита человека (ВИЧ I)
- Тимидинкиназа вируса простого герпеса (HSV-1)
- Щелочная фосфатаза E.coli
Противотуберкулезные тематика
- Аспартат аминотрасфераза AspC Mycobacterium tuberculosis
- Имидазол-глицерол-фосфатдегидратаза (hisB) Mycobacterium tuberculosis
- Кетол-кислотная редуктоизомераза Mycobacterium tuberculosis
- Кислая фосфатаза Mycobacterium tuberculosis
- Фосфопантетеин-аденилилтрансфераза Mycobacterium tuberculosis
- Ser/Thr-специфичная протеинкиназа Mycobacterium tuberculosis
- Продукт гена 1606 Mycobacterium tuberculosis
Прикладные работы
Мы осуществляем полный цикл работ в области генной инженерии: синтез гена и его клонирование в выбранный вектор, скрининг трансформантов и проверку экспрессии целевого гена, проводим оптимизацию экспрессии и ферментации, масштабирование стадии ферментации (от 250 мл до 200 л) и выделения (1 мг до 10 грамм). Разрабатываем стандартизованный протокол очистки целевого белка.
| ФИО | Должность | Контакты |
|---|---|---|
| Есипов Роман Станиславович, д.х.н. | г.н.с. | esipov@ibch.ru, +7(495)336-68-33 |
| Абрамчик Юлия Александровна | м.н.с. | |
| Заяц Евгений Андреевич | м.н.с. | |
| Костромина Мария Андреевна | н.с. | |
| Андронова В.Л. | инж.-иссл. | |
| Каранов Андрей Александрович | тех.-лаб. | |
| Птушкин В.А. | тех.-лаб. | |
| Пышко А.С. | тех.-лаб. | |
| Торская К.И. | тех.-лаб. | |
| Шарафутдинова Александра Ринатовна | тех.-лаб. | |
| Антонов К.В. | инженер | |
| Косарев С.А. | инженер | |
Ранее здесь работали | ||
| Жукова О.С. | ||
| Муравьёва Т.И., к.х.н. | ||
| Степаненко Василий Николаевич, к.б.н. | ||
| Чупова Л.А., к.х.н. | ||
| Богданова А.С. | ||
| Макаров Дмитрий Александрович, к.х.н. | ||
| Лыкошин Дмитрий Дмитриевич | ||
 Загрузка...
Загрузка...Научные проекты
 Загрузка...
Загрузка... Загрузка...
Загрузка...
