Лаборатория органического синтеза
|
Научно-исследовательские подразделения Руководитель: Формановский А.А. |
Лаборатория проводит молекулярный дизайн, разработку синтетических схем и синтез в препаративных количествах соединений самых разнообразных классов. Например, три- и тетрауглеводных рецепторов тетрасахарида SiaLex , замещенных арилборных кислот различной кислотности, производных индола, 7-гидроксикумарина, пиррол-2,3-дикарбоновой кислоты, ди- и трикарбоновых кислот ряда тиазола, олигоглицинов с фрагментами N-бензилглицина, фенилдигидронафталинов, 1,2-дигидрохинолин-3-карбоновой кислоты, сложных бициклических производных.
Лаборатория проводит эксперименты по поиску возможных условий абиогенного синтеза аденозина и аденозинмонофосфата, а также работы по изучению свойств, синтеза и возможного использования ионных жидкостей – принципиально нового типа растворителей.
Кроме того, сотрудники занимаются созданием флуоресцентных зондов для ДНК, анестетиков и миорелаксантов нового поколения, а также разрабатывают методы определения наркотических веществ.
Лаборатория сотрудничает с лабораториями Института, Институтом геохимии и аналитической химии имени В.И. Вернадского РАН, Химическим факультетом МГУ, Институтом молекулярной биологии им. В.А. Энгельгардта РАН, Институтом биохимии им. А.Н. Баха РАН, Российским химико-технологическим университетом имени Д.И. Менделеева и др.
Лаборатория создана на базе Группы органического синтеза (функционирует с 1994 года) в 2010 году.
- Разработка инновационных методов синтетической органической химии и принципиально новых схем синтезов органических соединений
- Практическое получение соединений различных классов: бензогетероциклов, арилсульфамидов и арилсульфоновых кислот, полициклических и каркасных соединений, арилборных кислот, продуктов деградации лекарственных веществ, антигенов и гаптенов, флуоресцентных меток, нетрадиционных аминокислот, спин-меченых аминокислот, хромофорных и фотосенсибилизирующих соединений, природных низкомолекулярных соединений.
- Синтезированы компоненты олигопептидных ингибиторов Plm II протеаз – ω-гидроксизамещенных L-α-аминокислот.
- Разработан новый препаративный метод синтеза аргиопина, синтезировано 100 г. этого природного токсина. Найденный метод использовался в синтезе аналогов аргиопина.
- Разработаны эффективные методы синтеза и получен представительный набор замещенных 2-тиазолил-1-алкил(арил)этанолов, перспективных шаблонов для получения новых фармакологических препаратов.
- Разработаны синтетические схемы и проведен синтез гаптенов, необходимых компонентов в иммуноферментном анализе токсичных компонентов бытовых моющих средств, загрязняющих окружающую среду, современных пестицидов и антибиотиков.
- Разработаны методы синтеза и получен фотопереключаемый фрагмент белка для создания управляемых элементов вторичной структуры; фотоактивируемые метки для исследования рецепторных систем; флуоресцентные метки для исследования строения и функционирования нуклеиновых кислот; фотосенсибилизирующие реагенты; флуоресцентные индикаторы.
- В рамках Программ Президиума РАН «Происхождение и эволюция биосферы» проведен анализ с использованием методов компьютерного синтеза вариаций абиогенных условий образования аденина, а также конденсации аденина с рибозой и рибозофосфатом; сформирована библиотека моносахаридов, разработаны методики их определения методами хромато-масс-спектрометрии и ГЖХ.
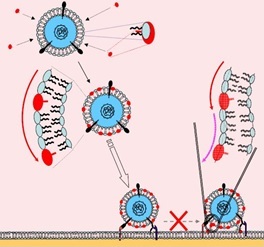
- Найден новый подкласс модифицированных нуклеозидов, обладающих высокой активностью в отношении оболочечных вирусов (см. рис. ниже). Cреди обнаруженного нами ранее (Биоорган. химия, 29 (3), 289–294 (2003), Nucleosides, Nucleotides & Nucleic Acids, 24(5/7), 923–926 (2005), Tetrahedron, 62 (6), 1279–1287 (2006), Вопросы вирусологии, 2006 (1), 34–38, Org. Biomol. Chem.,4 (6), 1091–1096 (2006)) класса противовирусных соединений выявлена группа веществ с высокой активностью в отношении оболочечных вирусов. В частности, IC50 5-(перилен-3-ил)этинил-2′-дезоксиуридина составляет 50 нмоль/л для вируса простого герпеса типа 1 и 180 нмоль/л для вируса гепатита C. Характерной особенностью структуры активных нуклеозидов является присутствие остатка пентациклического ароматического углеводорода перилена, жестко присоединенного к нуклеиновому основанию с помощью тройной связи. Высказано предположение, что уникальная структура полученных соединений обусловливает их встраивание в оболочку вириона, в результате чего слияние вириона с клеткой (инфицирование) становится весьма невыгодным процессом. Новые соединения практически не цитотоксичны.
| ФИО | Должность | Контакты |
|---|
 Загрузка...
Загрузка...Научные проекты
 Загрузка...
Загрузка...Формановский А.А.
Москва, ул. Миклухо-Маклая, 16/10 — На карте
 Загрузка...
Загрузка...
