Пресс-центр / новости / Наука /
Два лучше, чем один: стратегия двойного нацеливания адресными скаффолдовыми белками на один онкомаркер для синергичного уничтожения агрессивных опухолей и метастаз
Сотрудники Лаборатории молекулярной иммунологии ИБХ РАН совместно с российскими и зарубежными коллегами разработали новую стратегию адресной доставки соединений для терапии и диагностики раковых заболеваний, которая позволяет значительно повысить как эффективность диагностики, так и лечения агрессивных метастазирующих опухолей. Результаты данного исследования опубликованы в журнале ACS Nano (IF 14.588).
Онкозаболевания, являющиеся одной из самых серьёзных проблем биологии и медицины, требуют диагностики и вмешательства на самых ранних стадиях развития, что особенно критично в случае развития агрессивных метастазирующих опухолей. Для борьбы с этими заболеваниями традиционно применяют неспецифичные химиотерапевтические препараты, такие как доксорубицин, паклитаксел, метотрексат и другие, которые приводят к целому ряду серьёзных побочных эффектов. Чтобы понизить системную токсичность и повысить терапевтическую эффективность, часто используют различные виды комбинированной терапии – например, объединение химиотерапии, лучевой терапии, клеточной терапии и/или иммунотерапии.
Также эффективность лечения может быть повышена за счёт использования наночастиц различной природы, которые представляют собой идеальную платформу для доставки терапевтических соединений непосредственно к клеткам опухоли путём декорации поверхности частиц распознающими молекулами, приводящими их точно «в цель» с минимизацией побочных эффектов для организма.
В сочетании с иммунотерапией направленная доставка химиотерапевтических соединений является многообещающим подходом для комбинированной тераностики рака (комбинации диагностики и терапии при использовании одного соединения). Однако этот подход на сегодняшний день демонстрирует лишь ограниченный успех в связи с рядом проблем, таких как низкий терапевтический индекс традиционной химиотерапии, отсутствие широкого спектра онкомаркеров на поверхности клеток и ряда других факторов.
Виктория Шипунова, первый автор статьи, к.б.н., старший научный сотрудник Лаборатории молекулярной иммунологии, комментирует: «В опубликованной работе была разработана стратегия синергичной комбинированной адресной иммуно/химиотерапии в условиях двойного нацеливания препаратов на разные участки одного рецептора – онкомаркера HER2 на поверхности клеток. HER2 – клинически значимый онкомаркер, сверхэкспрессия которого часто ассоциирована с устойчивостью к химиотерапии, высоким метастазированием и плохим прогнозом.
А именно, для визуализации и терапии HER2-сверхэкспресссирующих опухолей одновременно были использованы:
1) наночастицы полилактида-ко-гликолида (PLGA), загруженные химиопрепаратом доксорубицином и визуализирующим красителем Nile Red, а также модифицированные адресным распознающим белком – анти-HER2 аффибоди,
2) адресный иммунотоксин DARP-LoPE, содержащий низкоиммуногенную модификацию терапевтического экзотоксина A (LoPE) и белок, нацеленный на HER2 рецептор – дарпин DARPin9.29».
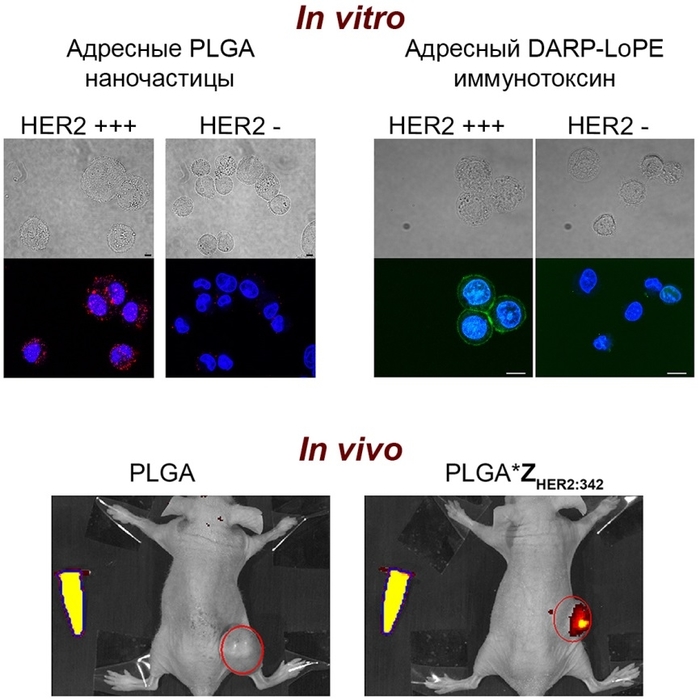
Рисунок 1. Мечение HER2-сверхэкспрессирующих клеток адресными наночастицами PLGA (слева вверху), адресным иммунотоксином (справа вверху). Ядра клеток окрашены Hoechst 3342 (синий цвет), PLGA – красный краситель Nile Red, иммунотоксин мечен FITC – зелёный цвет. Визуализация HER2-сверхэкспрессирующией опухоли (внизу) адресными наночастицами PLGA (справа) в сравнении с безадресными частицами (слева) – опухоль обведена красной линией, интенсивность свечения обусловлена наличием в составе наночастиц флуоресцентной метки Nile Red
В данной работе впервые использованы адресные скаффолдовые полипептиды для региоселективного нацеливания на один онкомаркер – в данном случае HER2. Скаффолдовые полипептиды являются новым популярным классом нацеливающих соединений для применения в биологии и медицине, обладающим целым рядом преимуществ по сравнению с традиционно используемыми полноразмерными антителами. При том, что эффективность нацеливания и константы связывания скаффолдов – дарпинов (14-16 кДа, 5-7 нм) и аффибоди (8 кДа, 3-4 нм) не уступают полноразмерным антителам (150 кДа, 7–14 нм), скаффолды отличаются гораздо меньшим размером, низкой иммуногенностью, отсутствием константных доменов, а также обладают прекрасной растворимостью и стабильностью в экстремальных условиях. Более того, отсутствие посттрансляционных модификаций позволяет легко нарабатывать большое количество таких белков в бактериальных продуцентах, а свободные N- и С-концы проводить генно-инженерные манипуляции, например, с целью создания белков слияния, таких как использованный в данной работе адресный иммунотоксин DARP-LoPE.
Следует отметить, что использование небольших каркасных белков является решающим фактором в данном исследовании, так как позволяет избежать стерических затруднений при одновременном нацеливании на один онкомаркер, как это часто имеет место в случае полноразмерных антител IgG.
«Использование двух адресных суперструктур позволило в 1000 раз снизить концентрацию действующих веществ для достижения того же терапевтического эффекта. Более того, комбинация этих препаратов действует синергично, то есть одно вещество значительно усиливает действие другого. Это особенно удивительно и неожиданно, поскольку оба препарата воздействуют всего на один клеточный рецептор. Такая синергия позволила значительно усилить эффективность терапии HER2-позитивных опухолей in vivo, а также полностью предотвратить появление метастазов» – комментирует Виктория Шипунова.
Также важно, что предлагаемая терапия, основанная на двойном нацеливании, реализована с использованием двух биосовместимых и биоразлагаемых структур, а именно белковый иммунотоксин и наночастицы из сополимера молочной и гликолевой кислот – веществ, представленных в организме человека. При этом оба соединения обладают всеми необходимыми для тераностики свойствами, а именно, способностью визуализировать очаг заболевания и селективно уничтожать клетки при наличии определённого сигнала (в данном случае, сверхэкспрессия HER2 рецептора), что делает эту стратегию очень привлекательной для быстрого внедрения в клиническую практику.
Кроме того, поскольку используемые тераностические агенты имеют разное происхождение и различаются по размеру, они выводятся из организма через разные метаболические пути и органы (печень/селезёнка для наночастиц и почки для белков). Таким образом, комбинируя лечебные средства и снижая их концентрацию, можно добиться минимизации воздействия на органы и кардинального уменьшения побочных эффектов, что очень важно для разработки эффективных стратегий онкотераностики.
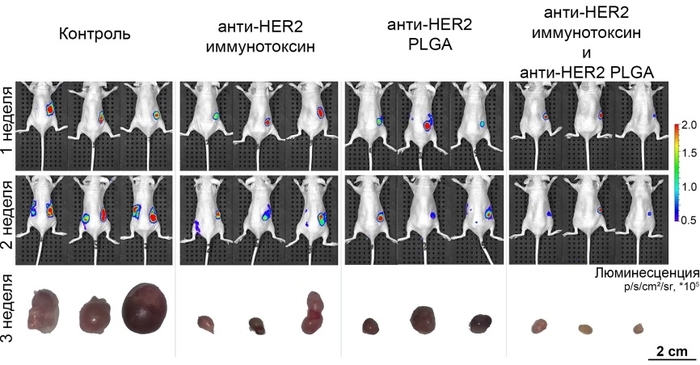
Рисунок 2. Эффективность комбинации адресных структур на основе скаффолдовых полипептидов для терапии HER2-положительных опухолей. При воздействии комбинации адресных препаратов наблюдается значительное уменьшение первичной опухоли (правый бок мыши), а также отсутствие метастаз в паховый лимфоузел (левый бок мыши). Изображения получены путём введения гена люцицеферазы NanoLuc в опухоли животных и последующей визуализацией животных системой прижизненного имиджинга IVIS Spectrum CT.
Авторы исследования полагают, что разработанная стратегия двойного нацеливания, подразумевающая «два агента – один рецептор» является шагом на пути к разработке эффективных методов лечения агрессивных опухолей. Авторы также считают, эту стратегию можно распространить на другие комбинированные методы лечения и противоопухолевые мишени, включая другие рецепторы семейства EGFR, молекулы клеточной адгезии и другие трансмембранные рецепторы.
Обеспечивая эффективную доставку терапевтических агентов в область опухоли, технология двойного нацеливания позволяет значительно снизить эффективную концентрацию лекарства для достижения того же эффекта. Ожидается, что такое снижение дозы лекарства сведёт к минимуму побочные эффекты, которые могут быть очень серьёзными при применении неспецифических химиотерапевтических препаратов, ограничивающих выбор последующих планов лечения. С другой стороны, использование биосовместимых наноструктур и синтетических неиммуногенных скаффолдовых белков для адресной доставки приводит к низкому иммунному ответу организма, что позволяет в случае необходимости повторить курс терапии. Кроме того, предлагаемая технология предлагает путь для высокоэффективного лечения в течение очень короткого периода времени, что очень важно для предотвращения метастазов в быстро развивающихся новообразованиях.
Исследование проведено в Лаборатории молекулярной иммунологии под руководством д.б.н., проф., академика РАН Деева Сергея Михайловича в сотрудничестве с Инженерно-физическим институтом биомедицины НИЯУ МИФИ и Институтом лазеров, фотоники и биофотоники Университета штата Нью-Йорк в Буффало (США). Эксперименты по биовизуализации опухолей в лабораторных мышах проводили с использованием оборудования ЦКП ИБХ РАН.
Исследование поддержано грантами Российского научного фонда № 17-74-20146 (синтез и характеризация частиц, исследования in vivo) и 19-72-30012 (электронно-микроскопические исследования), а также грантами РФФИ № 20-34-70136 и 19-29-04012 (работа с белками и культурами клеток).
21 сентября 2020 года




