Пресс-центр / новости / Наука /
Выбор редакции FEBS Journal: статья о пептидном модуляторе ASIC1a с уникальной структурой
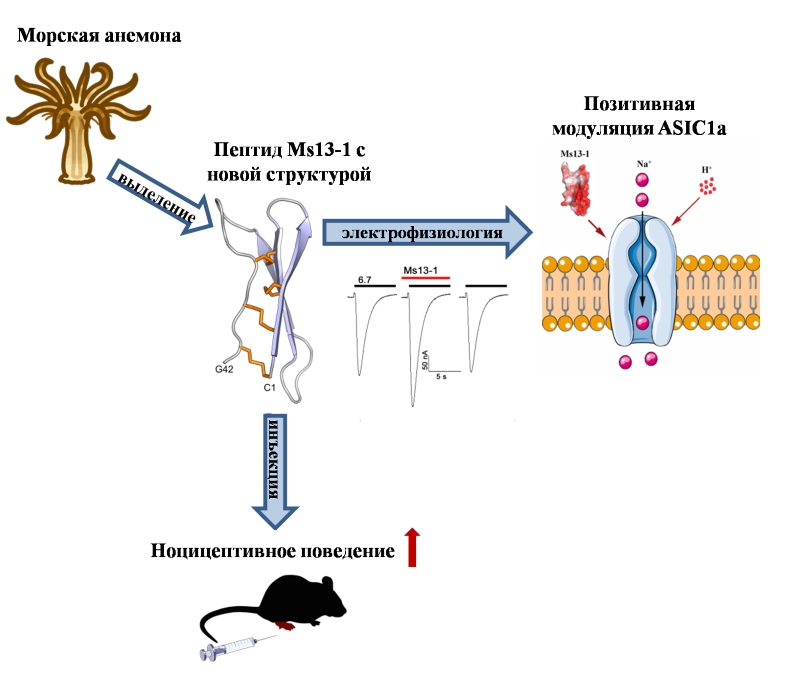
Исследователи из Лаборатории нейрорецепторов и нейрорегуляторов и Лаборатории биомолекулярной ЯМР-спектроскопии ИБХ РАН совместно с Лабораторией биологических испытаний ФИБХ выделили и охарактеризовали Ms13-1, новый пептид морской анемоны Metridium senile с уникальной трехмерной структурой и выраженным селективным действием на кислоточувствительные ионные каналы ASIC1a. Ms13-1 обладает пространственной укладкой, названной авторами «цистиновой лестницей», и является представителем нового структурного класса. В наномолярном диапазоне Ms13-1 действует как положительный аллостерический модулятор ASIC1a, а введение пептида в заднюю лапу мыши вызывает боль, которая подавляется селективным антагонистом ASIC1. Работа опубликована в FEBS Journal и отмечена как выбор редакции майского выпуска.
Известно, что некоторые животные вырабатывают ядовитые секреты, в которых присутствует большое разнообразие пептидных молекул (токсинов). Важной мишенью этих пептидов являются нейрональные ионные каналы, которые участвуют в генерации и передачи боли. Одними из них являются природные сенсоры протонов – ASIC-каналы, обильно представленные в периферической нервной системе млекопитающих. Однако, если для ASIC1b и ASIC3 изоформ достоверно показана связь с болью различных модальностей, то участие ASIC1a изоформы в этих процессах оставалось недостаточно изученным.
В рамках работы был проведен анализ эктодермального секрета морской анемоны Metridium senile. В нем был обнаружен пептидный компонент, названный Ms13-1, который селективно усиливал активацию гомомерных ASIC1a. Ms13-1 не активировал ASIC1a напрямую, но усиливал опосредованные им ионные токи до 50% в ответ на кислотные стимулы в диапазоне рН от 6,9 до 5,5 (EC50 = 68 нМ при pH 5,5). Было отмечено, что Ms13-1 не изменял сродство канала к связыванию протонов, что указывает на то, что его действие происходит по аллостерическому механизму.
Ms13-1 по своей первичной структуре не имеет гомологов среди известных пептидов. Также, анализ пространственной структуры с помощью спектроскопии ЯМР показал, что пептид обладает уникальным типом укладки. Ms13-1 принимает трехмерную структуру в виде антипараллельного β-листа из трех тяжей и протяженной С-концевой части пептида, которая «пришита» к β-листу тремя дисульфидными связями. Дополнительная четвертая дисульфидная связь стабилизирует два первых β-тяжа. Этот тип укладки был назван авторами статьи «цистиновой лестницей» («Cys-ladder») по визуальной аналогии.
В экспериментах на мышах введение Ms13-1 в заднюю лапу вызывало ярко выраженную продолжительную болевую реакцию. Этот эффект значительно подавлялся при совместном введении Ms13-1 и селективного блокатора ASIC1 мамбалгина-2, что указывает на непосредственное действие Ms13-1 на каналы ASIC1a in vivo. Следовательно, Ms13-1 может служить ценным инструментом для изучения путей передачи болевых сигналов с участием каналов ASIC1a. Его способность усиливать действие активаторов ASIC1a, присутствующих во внеклеточной среде, может быть использована в качестве нового инструмента для идентификации и характеристики следовых количеств эндогенных активаторов ASIC1a.
Работа была выполнена на базе Лаборатории нейрорецепторов и нейрорегуляторов ИБХ РАН, анализ пространственной структуры был выполнен К.С. Минеевым (Лаборатория биомолекулярной ЯМР-спектроскопии), а эксперименты на мышах были выполнены в Лаборатории биологических испытаний ФИБХ РАН. Результаты опубликованы в FEBS Journal и отмечены как выбор редакции майского выпуска журнала.
29 мая 2025 года


