Пресс-центр / новости / Наука /
Киназа-биоскэвенджер обеспечивает антибиотикорезистентность, необычайно эффективно связывая свой субстрат
Исследователи из Лаборатории биокатализа ИБХ РАН открыли фермент – киназу AmiN, обеспечивающую резистентность к антибиотику амикумацину. Уникальность данной киназы заключается в ее необычайно высоком сродстве к субстрату, позволяющему высокоэффективно элиминировать даже следовые количества антибиотика в диапазоне наномолярных концентраций. Комплекс методов, включающих рентгеноструктурный анализ и математическое моделирование, позволил детально исследовать совершенный механизм катализа, связанный с закрытием активного центра фермента. Результаты исследования опубликованы в журнале Science Advances,
Миллиарды лет эволюции привели к тому, что живые организмы создали широкую палитру высокотоксичных соединений, направленных на элиминацию конкурирующих видов. С другой стороны, неустанно происходила эволюция механизмов резистентности к этим соединениям. Эти эволюционно совершенные механизмы встречаются повсеместно во всех царствах, от микробов до многоклеточных организмов.
Конкурируя с природой, исследователи разработали искусственные каталитические биоскэвенджеры для защиты от высокотоксичных синтетических отравляющих веществ. Исследования в этой области показали, что защита от боевых отравляющих веществ может быть достигнута либо в результате необычайно эффективного и необратимого связывания, либо в результате ферментативного катализа с эффективностью на уровне диффузионного предела. Столь экстремальные параметры являются необходимым условием элиминации следовых количеств летальных агентов.
Биоразнообразие микробных сообществ поддерживаются сложной сетью взаимодействий между бактериями-убийцами и резистентными бактериями, конкурирующими друг с другом за колонизацию различных экологических ниш. Бактерии используют молекулы антибиотиков, чтобы убить своих конкурентов. В свою очередь, давление отбора стимулирует эволюцию ферментов, инактивирующих антибиотики. Таким образом, они могут рассматриваться как природные каталитические биоскэвенджеры, созданные для детоксикации сильнодействующих агентов. В отличие от искусственно созданных биоскэвенджеров, более широкая субстратная специфичность обычно является более выгодным вектором селекции в природных микробных сообществах, что наблюдается для ферментов, обеспечивающих устойчивость к аминогликозидам и макролидам.
Сотрудники Лаборатории биокатализа совместно с российскими и зарубежными коллегами провели исследование и идентифицировали уникальную киназу-биоскэвенджер AmiN бактерии Bacillus pumilus, выделенной из микробиоты пасти сибирского медведя (Ursus arctos collaris) с использованием ультравысокопроизводительной микрофлюидной платформы. Глубокое функциональное профилирование наивного медвежьего микробиома позволило отобрать продуцентов антибиотиков и антибиотикорезистентные бактерии. В отличие от обычных киназ, обеспечивающих устойчивость к антибиотикам, AmiN имеет выдающуюся каталитическую эффективность kcat/KM = 3.4 ± 0.7 × 108 M−1 с−1, близкую к диффузионному пределу. Эта необычайная каталитическая эффективность является следствием высокоэффективного связывания, одного из сильнейших среди ферментов, использующих низкомолекулярные субстраты. Скорость реакции подчиняется кинетике Михаэлиса-Ментен при субмикромолярных концентрациях антибиотика, демонстрируя KM 25 ± 5.2 нМ для амикумацина. Эти результаты согласуются с наблюдаемым Kd = 80 ± 25 нМ для комплекса AmiN с амикумацином в присутствии негидролизуемого аналога АТФ (AMP-PNP).
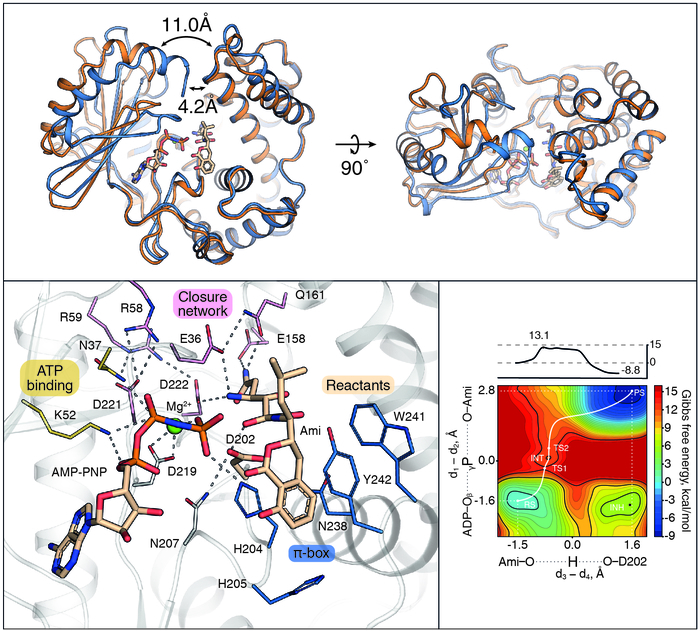
Исключительная специфичность AmiN в отношении амикумацина опосредована механизмом его функционирования, основанном на субстрат-зависимом закрытии активного центра. Уникальная аффинность AmiN к субстрату обусловлена наличием дополнительной субстрат-связывающей петли, образующей уникальную структуру – π-бокс, не встречающуюся у других киназ антибиотиков. Комплекс методов, включающих кристаллографический анализ и математическое моделирование, позволил детально исследовать совершенный механизм катализа, включающий динамику AmiN и перестройку активного центра, инициирующую фосфорилирование антибиотика.
Биологическая функция AmiN ассоциирована с кластером генов биосинтеза антибиотика амикумацина, содержащим киназо-фосфатазный цикл, регулирующий продукцию антибиотика и ауторезистентность. AmiN имеет многочисленных гомологов у бацилл (AmiN-подобные киназы), подчеркивающие его значимость для их экологии и выживания в дикой природе. Рекомбинантная продукция AmiN и его гомологов обеспечивает резистентность к амикумацину у бактерий, как грамположительных, так и грамотрицательных, а также клеток млекопитающих.
Киназа AmiN является членом ранее неизвестного подсемейства, которое эволюционировало для фосфорилирования узкого спектра антибиотиков, представляя первое свидетельство специализированного фосфотрансферазного биоскэвенджера. Открытие AmiN-подобных киназ является ярким примером того, что число неверно аннотированных ферментов, а также ферментов с уникальной функциональной активностью чрезвычайно обширно. Это существенно затрудняет точное предсказание резистомов. Всестороннее понимание эволюционных ландшафтов и биоразнообразия ферментов устойчивости к антибиотикам наряду с детализированным атомистической описанием механизмов резистентности улучшит прогнозирование угроз, которые несет антибиотикорезистентность, а также разработку направленных стратегий их предотвращения.
26 июня 2020 года




