Пресс-центр / новости / Наука /
Деполимеразы, полученные из областей профага Acinetobacter baumannii, гидролизующий капсульные полисахариды
Команда ученых из Лаборатории молекулярной биоинженерии ИБХ РАН совместно с коллегами из других российских институтов были предсказала и получила несколько различных рекомбинантных деполимераз, закодированных в профаговых областях генома Acinetobacter baumannii. Для двух деполимераз определена специфичность к капсулярным полисахаридам (КПС) A. baumannii, относящимся к капсульным типам К1 и К92 (К-типы). Эти ферменты можно рассматривать как подходящие кандидаты для разработки новых антибактериальных средств против соответствующих типов K A. baumannii.
Были предсказаны и получены несколько различных рекомбинантных деполимераз, закодированных в профаговых областях генома Acinetobacter baumannii. Анализ бактериальных геномов, в которых были обнаружены последовательности, свидетельствовал о том, что они, по-видимому, принадлежали к профаговым областям, содержащим гены, кодирующие сборку фага и структурные белки, продукты, участвующие в фаговом нуклеотидном метаболизме, упаковке ДНК в капсид, лизисе и интеграции ДНК фагов в бактериальные геномы.
Обнаружение отдаленной гомологии белков с помощью сравнения HMM-HMM мотивов, показало, что деполимеразы обладают многодоменной структурой. N-концевые части некоторых деполимераз имеют сходство с хвостовым волокном фага Escherichia T7. Остальные части всех проанализированных белков содержали области, которые проявляли сходство с различными ферментами, гидролизующими углеводы, или хвостовыми шипами литических фагов. Таким образом, изученные белки, скорее всего, относятся к деполимеразам хвостовых шипов профагов, которые участвуют на первых этапах взаимодействия с бактериями-хозяевами. Моделирование доменной организации мономеров деполимеразы, происходящих из профага, с помощью AlphaFold 2 также выявило несколько областей, соответствующих N-концевой, центральной и С-концевой частям.
Были клонированы, экспрессированы и очищены делеционные мутанты, лишенные N-концевых доменов, ответственных за присоединение узнающих/разлагающих частей деполимераз капсулярных полисахаридов (КПС), полученных из профага. Была выбрана стратегия клонирования только рецептор-связывающих/узнающих частей деполимераз, чтобы избежать возможной агрегации белков из-за гидрофобности их N-концов. Специфичность очищенных деполимераз, полученных из профагов, тестировали с использованием коллекции штаммов A. baumannii, принадлежащих к 56 различным типам капсул. Два из шести рекомбинантных белков, экспрессированных в E. coli, а именно DpoAB5075 и DpoB8300, проявляли деполимеразную активность на бактериальных газонах A. baumannii AYE и B8300, принадлежащих к капсульным типам K1 и K92 соответственно.
Учитывая, что КПС являются первичными рецепторами для несущих деполимеразу литических фагов A. baumannii, первый этап инфицирования бактериального хозяина умеренным фагом также может вызывать деградацию соответствующих КПС специфической структурной деполимеразой. Это подтверждается тем фактом, что деполимераза профага DpoB8300 разрушает ЦПС капсульного типа К92, к которому относится и штамм-хозяин A. baumannii B8300. Интересно что A. baumannii AB5075-UW, представитель капсульного типа К25, кодирует деполимеразу DpoAB5075, обладающую ферментативной активностью в отношении К1 CPS. Это можно объяснить возможными событиями рекомбинации между бактериальными геномами или горизонтальным переносом областей, содержащих профаги. Анализ олигосахаридных продуктов, полученных при деградации КПС A. baumannii рекомбинантными деполимеразами профагового происхождения DpoAB5075 и DpoB8300, показал, что ферменты представляют собой специфические гликозидазы, расщепляющие КПС по гидролитическому механизму с образованием мономера и олигомеров К1 и К92. единиц соответственно.
Капсула, содержащая повторяющиеся полисахаридные звенья, является основной детерминантой вирулентности A. baumannii, которая защищает бактерии от иммунной защиты хозяина. Таким образом, КПС -деградирующие ферменты или деполимеразы, закодированные в фаговых геномах, могут представлять собой эффективные противовирулентные агенты. Противовирулентную эффективность нескольких деполимераз, закодированных в геномах литических фагов КПС, исследовали с использованием модели Galleria mellonella. В частности, было показано, что специфическая деполимераза K2 (B3gp42), кодируемая в геноме фага vB_AbaP_B3 (GenBank: MF033348), защищает личинки Galleria mellonella от бактериальных инфекций при использовании либо предварительной обработки, либо однократных инъекций фермента после бактериального заражения дозозависимым образом. Ранее было показано, что деполимераза Dpo48, закодированная в геноме фага IME200 (GenBank: KT804908), снижает вирулентность клеток-хозяев A. baumannii.
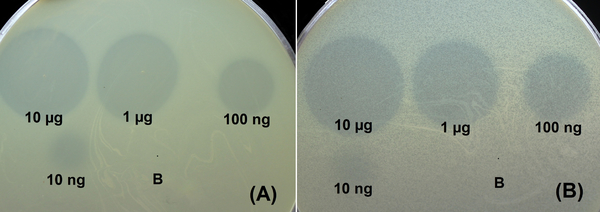
Рисунок 1. Спот-тест с серийным 10-кратным титрованием очищенных рекомбинантных деполимераз DpoB8300 (A) и DpoAB5075 (B) и на газонах A. baumannii B8300 и AYE соответственно после 18 ч инкубации; "B" – буфер (20 мМ трис-HCl, pH 7,5 и 150 мМ NaCl) для хранения белков в качестве отрицательного контроля.
В этом исследовании было впервые продемонстрировано, что рекомбинантные деполимеразы профагового происхождения с установленной ферментативной активностью могут значительно снижать смертность личинок G. mellonella, инфицированных A. baumannii типов K. В долгосрочной перспективе это означает, что специфические деполимеразы, происходящие из профагов, а также ферменты, закодированные в геномах литических фагов, обладают большим потенциалом в качестве противовирулентных агентов для биоконтроля Acinetobacter baumannii.
Работа опубликована в журнале International Journal of Molecular Sciences.
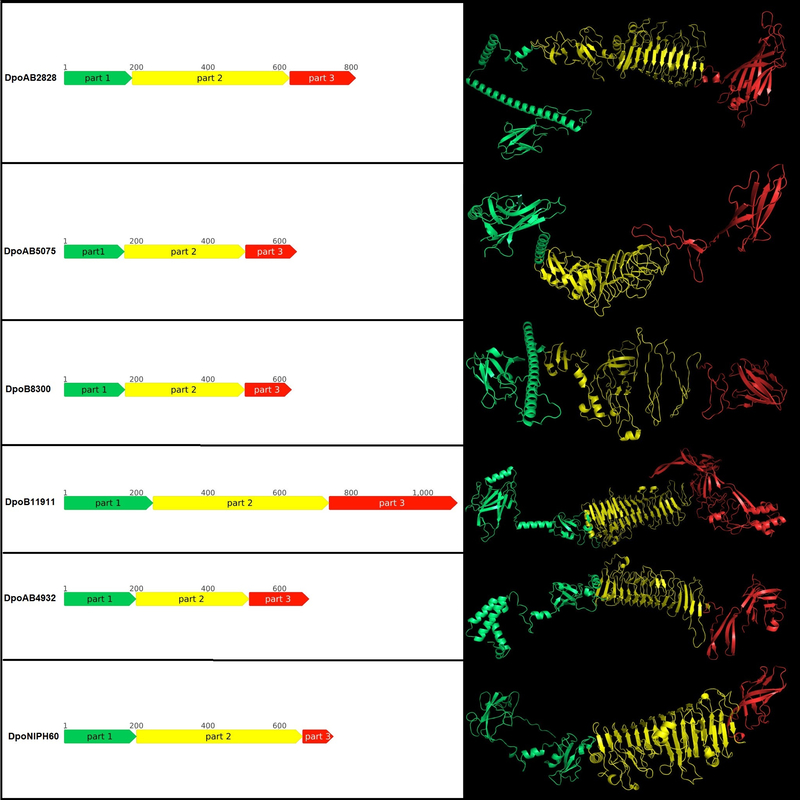
Рисунок 2. Схематическое изображение и предсказанная пространственная структура деполимераз, происходящих из профага. Части белков окрашены в соответствии с их предполагаемой ролью. Часть 1 (окрашена зеленым) содержит N-концевой домен, связывающий частицу, часть 2 (окрашена желтым) содержит центральный пирамидальный домен, часть 3 (окрашена красным) содержит С-концевой домен.
16 июня 2022 года


