Пресс-центр / новости / Наука /
Путь к изучению рецепторных тирозинкиназ
Рецепторные тирозинкиназы - одно из важнейших звеньев в системе передачи сигналов в клетке. Они играют ключевую роль в регуляции межклеточных взаимодействий, пролиферации клеток, морфогенеза и метаболизма. Нарушения их функции связаны с такими социально значимыми заболеваниями, как рак и сахарный диабет. В Институте биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова изучением рецепторных тирозинкиназ занимаются сразу несколько научных групп.
Под руководством заведующего лабораторией биомолекулярной ЯМР спектроскопии, д.х.н. профессора А.С. Арсеньева совместно с отделом Биоинженерии ИБХ РАН был проведен ряд экспериментов по изучению рецепторной тирозинкиназы VEGFR-2. Она относится к семейству рецепторов сосудистых эндотелиальных ростовых факторов, регулирует процессы ангиогенеза и является одной из ключевых мишеней для противоопухолевых препаратов. Отличительной особенностью, рецепторных тирозинкиназ является наличие одного трансмембранного сегмента, соединяющего внеклеточную часть и расположенные внутри клетки домены. В рамках эксперимента ученые исследовали роль трансмембранного сегмента рецептора в процессах активации рецептора и обнаружили ряд мутаций, которые способны вызывать лиганд-независимую активацию VEGFR-2, а также VEGFR-2 с «вырезанным» внеклеточным доменом. Для проведения детального исследования трансмембранного домена ученые разработали специальную методику, позволяющую измерять свободную энергию ассоциации трансмемембранных спиралей в мицеллярных средах методами ЯМР спектроскопии высокого разрешения, что позволило для всех трех объектов измерить величины свободной энергии димеризации, и, где возможно, тримеризации. На основании данных мутагенеза, ЯМР-спектроскопии и полученных пространственных структур был предложен механизм активации VEGFR-2, подразумевающий существование неактивного димерного состояния рецептора.
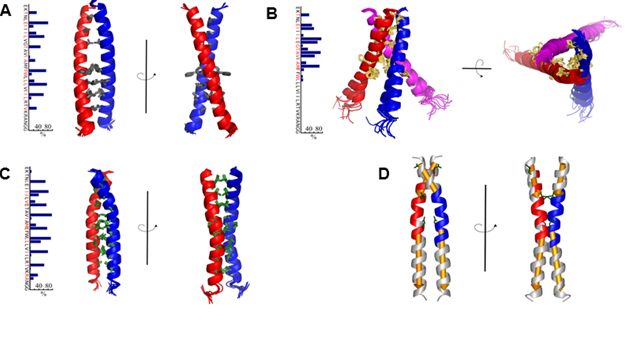
Рис. 1. Пространственные структуры димера ТМ домена VEGFR-2 дикого типа (А), тримера ТМД VEGFR V769E (B), и димера ТМД VEGFR-2 G770E/F778E (С). D, Структура димера ТМ домена VEGFR-2 G770E/F778E, окрашенная в соответствии с внутримолекулярной подвижностью.
Для понимания функционирования рецепторных тирозинкиназ необходимо изучение механизма передачи сигнала активации с внеклеточной стороны мембраны в цитоплазму. Известно, что внеклеточное взаимодействие эфринового рецептора EphA2 с лигандом-активатором вызывает димеризацию рецептора, которая происходит с участием как внеклеточных, так и цитоплазматических доменов. Димеризация способствует фосфорилированию рецепторов EphA2, что является ключевым шагом в запуске внутриклеточных сигнальных каскадов. Какова при этом роль трансмембранных доменов эфриновых рецепторов было не известно. Разработка новых методик проточной цитометрии, выполненная научным сотрудником, к.ф.-м.н. Г.В. Шароновым, и их применение к изучению рецепторов EphA2 с мутациями, введенными в трансмембранный домен, позволили найти ответ на этот вопрос. В результате исследований, проведенных в Лаборатории оптической микроскопии и спектроскопии биомолекул по руководством д.б.н А.В. Феофанова, было установлено, что трансмембранные домены рецепторов EphA2 формируют два отличающихся по структуре типа димеров, которые стабилизируют активную или неактивную конформацию рецептора. Высокая плотность рецепторов в мембране способствует активации EphA2 даже в отсутствии лиганда. Конформация димеров трансмембранного домена модулирует, как лиганд-зависимый, так и лиганд-независимый механизмы активации EphA2. Впервые получены экспериментальные данные, свидетельствующие, что переключение между двумя типами димеров трансмембранного домена является активным элементом механизма передачи сигнала у эфриновых рецепторов.
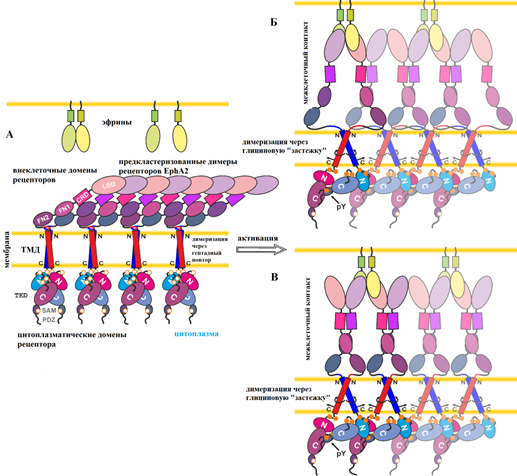
Рис. 2. Механизм активации EphA2 с учетом новых данных о двух альтернативных конфигурациях ТМД димеров. Рисунок адаптирован из статьи (Sharonov et al. JBC 2014).
Лаборатория клеточной биологии рецепторов ИБХ РАН во главе с д.х.н., А.Г. Петренко предложила модель активации рецепторной тирозинкиназы, которая была подробно описана в статье в международном научном журнале Biochimie. Новая модель активации рецепторных тирозинкиназ основана на анализе активности мутантов рецепторов и включает в себя описание специфических участков рецептора, ответственных за его активацию в щелочной среде. Старшим научным сотрудником лаборатории клеточной биологии рецепторов ИБХ РАН, к.ф-м.н. Игорем Деевым был разработан и впервые использован в серии экспериментов новый метод сравнения активации рецепторов - аутофосфорилирование in vitro, который позволяет количественно сравнивать активацию рецептора и его мутантов. С помощью этого метода ученые показали, что рецептор имеет два основных участка вовлеченных в его ответ на изменения pH. Первый расположен между L1C доменами одной мономерной субъединицы и доменами FnIII-2 и FnIII-3 от второй мономерной субъединицы, и второй между L2 и FnIII-1 доменами. Причем первый участок имеет большее значение для успешной активации рецептора. Более подробно про модель активации рецептора можно прочитать в пресс-релизе. Дальнейшее изучение рецепторных тирозинкиназ может внести значительный вклад в понимание процессов, происходящих как при физиологической активации рецептора инсулина, так и при патологических нарушениях, возникающих у пациентов с сахарным диабетом.
23 апреля 2015 года

