Пресс-центр / новости / Наука /
Новый класс природных пептидов: аналоги люциферина почвенного червя Fridericia heliota
Группа ученых из ИБХ РАН в сотрудничестве с красноярским Институтом биофизики (ИБФ СО РАН) представила новые достижения в рамках проекта по изучению биолюминесцентной системы сибирского червя: в статье, вышедшей в журнале Chemistry — A European Journal, описано установление структур ряда природных аналогов люциферина Fridericia heliota [1].
Рисунок для привлечения внимания
Исследования люминесценции живых организмов, так называемого «холодного света», начались еще в 19 веке. На сегодняшний день известно около 30 механизмов биолюминесценции, а найденных люциферинов — молекул, ответственных за излучение света — всего семь. Структура восьмого люциферина из червя Fridericia heliota была расшифрована в 2014 году совместными усилиями ученых из ИБХ РАН и ИБФ СО РАН [2, 3]. Как только становится известна формула люциферина, сразу встают вопросы — как он образуется в живом организме? Как устроен белок-люцифераза, который «зажигает» люциферин? Как вообще работает эта биолюминесцентная «машина»?
В настоящее время ученые под руководством Ильи Ямпольского подробно исследуют новую биолюминесцентную систему из Fridericia heliota. В экстракте червей обнаружен ряд аналогов люциферина, названных соответственно AsLn5, AsLn7, AsLn11 и AsLn12. Вещества были выделены в количествах по несколько десятков микрограммов, и для установления их структуры был привлечен ряд современных физических методов. Все они представляют собой необычные пептиды, построенные комбинацией остатков модифицированного тирозина (CompX и CompY) и γ-аминомасляной кислоты, треонина, гомоаргинина либо несимметричного N,N-диметиларгинина.
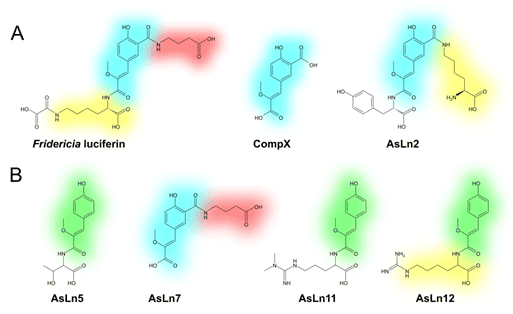
Рисунок 1. Структуры люциферина Fridericia heliota и его аналогов с ядром CompX (выделено голубым) и CompY (выделено зелёным).
Хромофором в люциферине Fridericia heliota является модифицированное тирозиновое ядро, названное авторами работы CompX (см. рис. 1). Анализ ЯМР и УФ спектров (см. рис. 2) аналогов люциферина показал, что в одном из них — AsLn7 — такой же хромофор. А в трех других хромофор отличается.
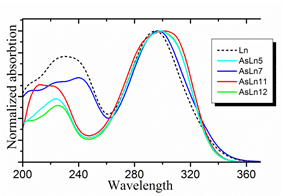
Рисунок 2. Спектры УФ соединений AsLn5, AsLn7, AsLn11, AsLn12 в сравнении c люциферином Fridericia.
Новый хромофор по аналогии с уже известным CompX назвали CompY. Для подтверждения конфигурации двойной связи в CompY был проведен встречный синтез двух его изомеров Z и Е.
Строение других фрагментов и порядок их соединения в AsLn5, AsLn11 и AsLn12 были определены комбинацией методов ЯМР- и масс-спектрометрии. Интересно, что титрование образца в процессе съемки ЯМР-спектра позволяет по изменению химических. сдвигов протонов определить и порядок пептидных связей в молекуле (этот метод был использован нами ранее при определении структуры люциферина [3]).
Строение пептидов AsLn5, AsLn7, AsLn11 и AsLn12 очень необычно для наземных животных. Интересно, что фрагмент CompX уникален для червей F. heliota, в то время как CompY, отличающийся от CompX отсутствием карбоксильной группы в ароматическом ядре, был зафиксирован как структурный фрагмент веществ, выделяемых из асцидий [4, 5].
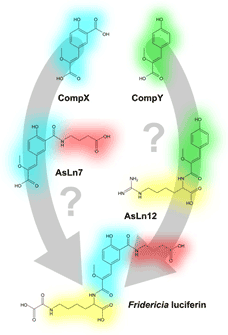
Рисунок 3. Предполагаемые пути биосинтеза люциферина Fridericia heliota на основании структур обнаруженных пептидов.
Почему у червей встречается именно такой набор веществ? Как они взаимосвязаны биосинтетически? Получает ли червяк их из пищи или синтезирует сам? Все эти вопросы тесно связаны с проблемой биосинтеза люциферина (см. рис. 3). Возможно, люциферин последовательно «собирается» в организме червяка из аминокислот с помощью ферментов — и эту точку зрения подтверждает структура AsLn7. Однако возможно, что люциферин получается из AsLn12 последовательным карбоксилированием и замещением гуанидинового фрагмента на оксалат. Какой путь правильный, пока трудно сказать. Разгадка структуры природных аналогов люциферина — это лишь первый шаг на пути к установлению пути биосинтеза люциферина. И пусть пока возникает больше вопросов, чем ответов, но истина «светит» где-то впереди.
Литература
-
Dubinnyi M.A., Tsarkova A.S., Petushkov V.N., Kaskova Z.M., Rodionova N.S., Kovalchuk S.I., Ziganshin R.H., Baranov M.S., Mineev K.S., Yampolsky I.V. (2015). Novel Peptide Chemistry in Terrestrial Animals: Natural Luciferin Analogues from the Bioluminescent Earthworm Fridericia heliota. Chem. Eur. J. 21,
2–8. doi: 10.1002/chem.201406498; - Пресс-релиз на сайте ИБХ от 16.04.2014: «Восьмая формула света»
-
Petushkov V.N., Dubinnyi M.A., Tsarkova A.S. et al. (2014). A novel type of luciferin from Siberian luminous earthworm Fridericia heliota: structure elucidation by spectral studies and total synthesis. Angew. Chem. Int. Ed. 53,
5566–5568; -
Kehraus S., Gorzalka S., Hallmen C., Iqbal J., Müller C.E., Wright A.D., Wiese M., König G.M. (2004). Novel amino acid derived natural products from the ascidian Atriolum robustum: identification and pharmacological characterization of a unique adenosine derivative. J. Med. Chem. 47,
2243–2255; -
Yin S., Cullinane C., Carroll A.R., Quinn R.J., Davis R.A. (2010). Botryllamides K and L, new tyrosine derivatives from the Australian ascidian Aplidium altarium. Tetrahedron Lett. 51,
3403-3405.
4 февраля 2015 года
Источник: http://dx.doi.org/10.1002/chem.201406498

