Пресс-центр / новости / Наука /
ЯМР-спектроскопия выявляет закономерности и термодинамические параметры димеризации β-шпилечных антимикробных пептидов в мембране
Сотрудники Лаборатории структурной биологии ионных каналов и Отдела «Учебно- научный центр» впервые изучили термодинамику процесса димеризации β-шпилечного пептида в мембраноподобной среде мицелл детергента на примере антимикробного пептида (АМП) капителлацина морской полихеты Capitella teleta и описали механизм его действия на мембраны бактерий. Результаты работы опубликованы в журнале Biomolecules.
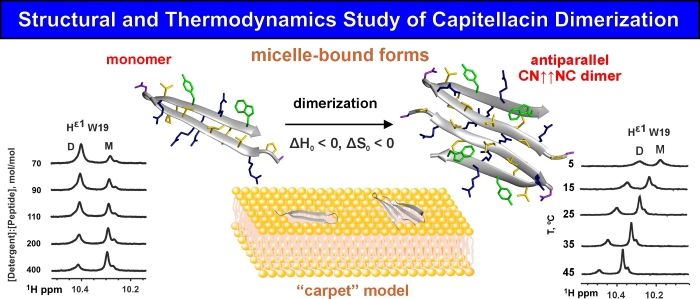
С помощью ЯМР-спектроскопии были определены структуры двух форм капителлацина в мицеллах – мономер в конформации β-шпильки и димер, образованный путем антипараллельной ассоциации N-концевых β-тяжей пептида. Переходы между этими формами происходили при изменении температуры и соотношения концентраций пептида и детергента. Как оказалось процесс димеризации β-шпилечных пептидов происходит за счет взаимодействия полярных или слабо гидрофобных областей мономеров и зависит в большей степени от межмолекулярных взаимодействий (водородные связи и электростатические и ван-дер-ваальсовые взаимодействия), чем от гидрофобного эффекта. Процесс димеризации характеризуется отрицательным изменением энтальпии и энтропии.
Изучив топологию обеих форм капителлацина в мицелле и распределение полярных и гидрофобных областей на поверхности молекул, мы пришли к выводу, что мембранолитическое действие капителлацина происходит по “ковровому” механизму. Это объясняет более низкую мембранную, антибактериальную и гемолитическую активности капителлацина по сравнению с другими β-шпилечными пептидами, способными образовывать поры в мембранах клеток. Сравнение структурных и физико-химических свойств известных β-шпилечных АМП в мономерной и димерной формах выявило положительную корреляцию между стабильностью димерной формы, гемолитической активностью АМП и гидрофобностью его поверхности. Что удивительно, также наблюдалась слабая положительная корреляция между общим зарядом молекулы АМП и гемолитической активностью.
Полученные результаты позволяют более точно описать механизмы фолдинга β-структурных мембранных белков, имеющих структуру β-бочонка, и образования олигомерных трансмембранных пор β-структурными пептидами. Мы надеемся, что изучение взаимосвязи между пространственной структурой и биологической активностью АМП поможет разработать новые антибиотики, так необходимые в современной медицине.
10 апреля


