Пресс-центр / новости / Наука /
Биофизики впервые смогли in silico изучить температурную активацию TRPV1
Учёные из Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН (ИБХ РАН) при помощи метода компьютерного моделирования впервые смогли изучить явление температурной активации рецептора TRPV1 высших организмов. Прежде эксперименты in silico не позволяли добиться подобных результатов из-за несовершенства компьютерных моделей. Результаты опубликованы в журнале Scientific Reports.
– История этого исследования началась, когда наши коллеги из Лаборатории нейрорецепторов и нейрорегуляторов попросили изучить динамику и свойства рецептора TRPV1 для создания новых противовоспалительных и анальгетических препаратов, – рассказывает Антон Чугунов, кандидат физико-математических наук, сотрудник Лаборатории моделирования биомолекулярных систем ИБХ РАН, один из авторов статьи. – Её бывший руководитель, известный в мире учёный Евгений Васильевич Гришин, стал инициатором этого исследования, его памяти мы и посвятили нашу работу. Мы довольно быстро предоставили коллегам необходимую информацию, но в ходе расчетов обнаружили, что можем наблюдать нечто большее – эффект температурной активации рецептора. Это настолько тонкий процесс, а моделирование методом молекулярной динамики, которое позволяет изучать «поведение» белков, – настолько пока что неточный «молекулярный микроскоп», что мы были поражены открывшимся возможностям.
TRPV1 – один из членов семейства TRP-рецепторов (белков), который участвует в системе поддержания постоянной температуры тела. В конце прошлого века американский учёный Дэвид Джулиус из Калифорнийского университета Сан-Франциско одним из первых выявил терморегулирующую функцию этого ионного канала, который при повышении температуры начинает пропускать ионы натрия, магния и кальция сквозь клеточную мембрану, подавая клетке сигнал об изменении окружающих условий. Позже профессор Джулиус расшифровал пространственную структуру рецептора TRPV1 при помощи метода крио-электронной микроскопии, который позволяет рассмотреть замороженный при высоком давлении объект незначительного размера (10-15 нм). Изъяном полученной структуры было то, что статический замороженный рецептор частично не поддавался расшифровке в области динамических изменений, которая является наиболее интересной для учёных. Поэтому до настоящего момента процесс активации рецептора оставался не до конца ясным. Антон вместе с коллегами из ИБХ РАН восполнили этот пробел.
– Мы взяли компьютерную модель рецептора в двух состояниях: в открытом и в закрытом, – объясняет Антон Чугунов. – Чтобы увидеть его работу, мы провели впечатляющие по длительности расчеты молекулярной динамики (целый год!), а также воспользовались методом компьютерного «картирования» поры. Мы «разворачивали» пору, то есть проецировали свойства ее внутренней – каналобразующей – поверхности на плоскость и наглядно визуализировали их при разных температурах. С помощью специально разработанной программы мы следили за изменением радиуса поры, которое происходило постепенно во времени: шаг за шагом, как это происходит в живой клетке. Зарегистрированные сильные скачки на графике означали, что пора меняла состояние с закрытого на открытое, но не наоборот. Мы знали, что рецептор активируется при температуре выше 43°С, причём каждый может ощутить это, опустив руку в горячую воду. Поэтому мы посчитали молекулярную динамику для каждого состояния при четырех температурах: две были выше и две ниже 43°С. Результаты оказались неожиданными.
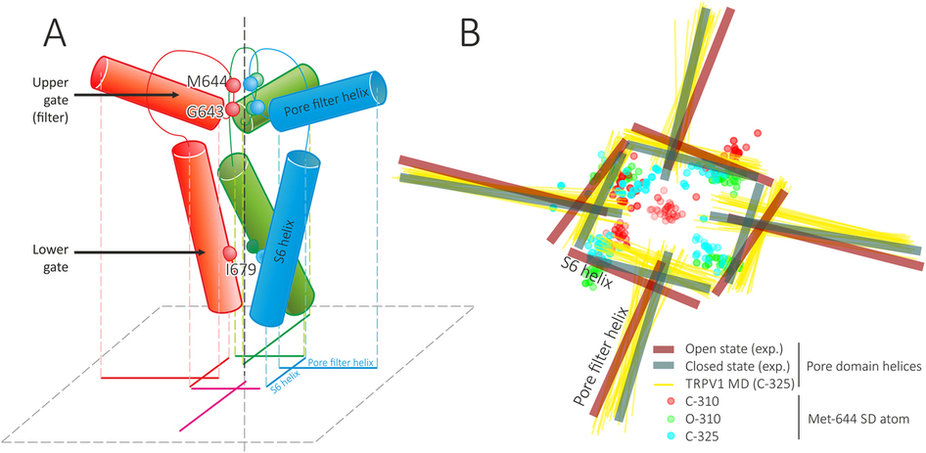
(А) Schematic representation of pore domain architecture and a projection that is used in panel (B) For each TRPV1 subunit (individually colored; the nearby one is omitted for clarity) two helices (pore filter (PF) and S6) and pore loop are shown.Spheres depict positions of several important residues: Gly 643 and Met 644 (upper gate) and Ile 679 (lower gate). A gunsight-like symbol is a projection of these eight helices (two from each subunit) on a membrane-parallel plane (dashed gray); two from one monomer are subscribed. Pore axis is shown with vertical dashed line. (B) Dynamic features of pore helices and Met 644 side chain in MD simulations. Thick lines show positions of TRPV1 pore helices (PF and S6) in closed (teal) and open (maroon) experimental structures. Thin yellow lines show positions of pore helices in C-325 MD trajectory. Circles depict projections of Met 644 SD atom in C-310 (red), O-310 (green) and C-325 (cyan) trajectories. Note that Met 644 SD atom from one of subunits blocks the pore in C-310 trajectory.
Логично было предполагать, что рецептор, расчёт молекулярной динамики которого был запущен в состоянии закрытой поры канала, должен оставаться закрытым при двух нижних температурах и открываться при двух высоких, и наоборот. Однако вычислительный эксперимент показал, что в закрытом состоянии пора канала открывалась при высоких температурах, но при расчёте из открытого состояния поры низкие температуры не закрывали пору в течение расчётного времени (до 1 микросекунды).
– Получилась некая асимметрия: ионному каналу гораздо проще открываться, чем закрываться, – заключает Антон.
Опубликованные данные показывают, что современные вычислительные мощности помогают исследовать ионные каналы и особенности их работы во временных интервалах, которые пока невозможно регистрировать экспериментально. Кроме того, мы наблюдаем за переходами внутри молекулы рецептора, как если бы у нас был «молекулярный микроскоп».
Конечной целью работы можно считать создание в ближайшем будущем виртуального рецептора TRPV1, пригодного для предсказания структуры селективных лигандов. Ожидается, и не без основания, что такие лиганды найдут применение в медицине как анальгетические лекарства и будут лишены большинства побочных эффектов, свойственных современным препаратам группы нестероидных противовоспалительных средств.
13 сентября 2016 года

