Лаборатория оптической микроскопии и спектроскопии биомолекул
|
Руководитель: Феофанов Алексей Валерьевич |
Лаборатория исследует биологически активные молекулы, мембранные и мембраноактивные белки, а также разрабатывает новые методики оптической микроскопии и спектроскопии применительно к этим задачам. Развиваемые методы применяются для изучения механизмов действия и структурно-функциональных взаимосвязей исследуемых молекул на разных уровнях структурной организации: молекулярном, клеточном и тканевом.
Методики микроскопии одиночных молекул и их комплексов разрабатываются в Лаборатории с помощью уникального научного оборудования. Оно включает в себя установку для однофотонной и многофотонной 4π-микроскопии сверхвысокого разрешения и установку для флуоресцентной микроскопии на основе эффекта полного внутреннего отражения. Обе установки обладают высокой чувствительностью, позволяющей регистрировать сигналы флуоресценции даже от одиночных молекул.
Также в Лаборатории создана экспериментальная установка для конфокальной лазерной микроспектроскопии и разработан метод конфокальной микроспектроскопии и реконструкции спектральных изображений (КОМИРСИ), который дает возможность идентифицировать и изучать молекулярные взаимодействия биологически активных соединений в живых клетках с трехмерным субмикронным пространственным разрешением. Установка и метод КОМИРСИ нашли широкое применение в разработках, научных и клинических исследованиях новых отечественных фотосенсибилизаторов для фотодинамической терапии рака, а также в исследованиях мембранных и мембраноактивных белков.
Лаборатория оптической спектроскопии и микроскопии биомолекул открыта для сотрудничества с подразделениями Института и другими научными организациями.
Так, разработка аналитических систем на основе гибридных ионных каналов для поиска и изучения блокаторов калиевых каналов ведется совместно с Группой нанобиоинженерии. В сотрудничестве с Группой молекулярных инструментов для нейробиологии проводится поиск и изучение блокаторов калиевых каналов в ядах скорпионов. Изучение функциональных свойств токсинов из яда змей ведется совместно с Лабораторией молекулярной токсинологии.
Кроме того, Лаборатория проводит совместные исследования с рядом других научных организаций. Изучением фотосенсибилизаторов для фотодинамической противораковой и антимикробной терапии и оптимизацией их свойств Лаборатория занимается в сотрудничестве с Московским технологическим университетом, МНИОИ им. П.А. Герцена и государственным научным центром «НИОПИК». Совместно с кафедрой Биоинженерии, Лабораторией регуляции транскрипции и репликации Биологического факультета МГУ и коллегами из Fox Chase Cancer Center (США) с применением методов флуоресцентной микроскопии одиночных молекул и их комплексов проводятся исследования структурных перестроек в нуклеосомах под действием различных ядерных белков. Оптимизация структуры конъюгатов бор-содержащих наночастиц и природных порфиринов ведется совместно с Московским технологическим университетом и ИНЕОС РАН.
Лаборатория также сотрудничает с зарубежными научными организациями. Совместно с Университетом Франсуа Рабле (Université Francois Rabelais, Тур, Франция) и Университетом прикладных наук Рейн-Ваал (Hochschule Rhein-Waal, Германия) разрабатываются биомедицинские наносенсоры для диагностики и лечения рака молочной железы.
Сотрудники Лаборатории преподают основы оптической микроскопии студентам УНЦ ИБХ РАН и кафедры Биоинженерии Биологического факультета МГУ им. М. В. Ломоносова. Под руководством сотрудников Лаборатории ежегодно выполняется несколько бакалаврских и магистерских работ, ведутся научные исследования аспирантов и молодых ученых.
Лаборатория оптической микроскопии и спектроскопии биомолекул была создана в 2005 году. Она входит в состав Отдела структурной биологии, который образован вследствие реорганизации Лаборатории инструментальных методов анализа, проведенной по инициативе нынешнего руководителя Отдела профессора А.С. Арсеньева.
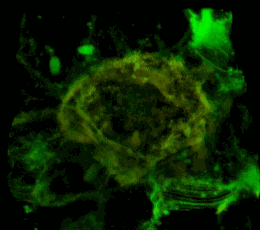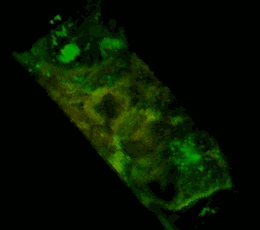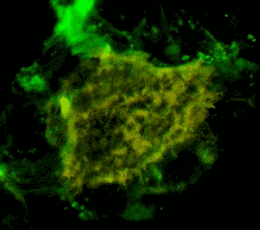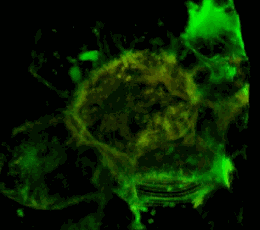
Трехмерное конфокальное изображение клеток HEK293, в которых достигнута стабильная экспрессия рецептора эфринов EphA2, слитого с циановым флуоресцентным белком (показан зеленым цветом), совместно с EphA2, слитым c желтым флуоресцентным белком (показан красным цветом). Совпадение локализации двух конструкций показано желтым цветом. Клеточная модель используется для изучения механизмов активации и димеризации эфриновых рецепторов с применением метода резонансного переноса энергии флуоресценции (FRET).
- Разработаны клеточные биоинженерные системы и методы их применения с использованием флуоресцентной микроскопии. Они используются для изучения поровых блокаторов потенциал-зависимых калиевых каналов и поиска пептидных блокаторов в природных ядах.
- На основе флуоресцентных белков и токсинов скорпионов созданы высокоаффинные конъюгаты, селективно взаимодействующие с Кv1-каналами и применимые для визуализации этих каналов.
- В ядах скорпионов обнаружены и охарактеризованы по активности новые высокоаффинные блокаторы каналов Кv1.х (х=1-3,6).
- Созданы рекомбинантные пептиды-блокаторы с улучшенной селективностью взаимодействия с Кv-каналами. Построены молекулярные модели комплексов пептидов-блокаторов с Кv-каналами. Описаны интерфейсы взаимодействия и аминокислотные остатки, влияющие на силу и селективность взаимодействия.
- На основе микроскопии Фёрстеровского резонансного переноса энергии разработаны методики исследования одиночных молекул и их комплексов в режиме свободной диффузии и в иммобилизованном состоянии. Показана применимость этих методик для изучения структурных перестроек нуклеосомной ДНК под действием различных белковых факторов.
- Оптимизированы структуры новых конъюгатов бор-содержащих наночастиц и природных порфиринов, что позволило осуществить доставку в раковые клетки более 1 млрд. атомов бора на клетку. Это обеспечило применимость новых наноконъюгатов для бор-нейтронозахватной терапии (БНЗТ). Наноконъюгаты являются также активными фотосенсибилизаторами и вызывают фотоиндуцированную гибель опухолевых клеток в наномолярных концентрациях. Новые конъюгаты - перспективные полифункциональные агенты для фотодинамической терапии, БНЗТ и флуоресцентной диагностики рака. Установлено, что ключевым структурным элементом, определяющим высокое накопление конъюгатов хлорина е6 с наночастицей бис-дикарболида кобальта в раковых клетках, является амино-полиалкил-аминный линкер, соединяющий порфириновый хромофор с наночастицей, а в основе их фотоцитотоксичности лежит фотоиндуцированное перекисное окисление липидов, пермеабилизация лизосом, и активация протеаз в цитоплазме клеток.
| ФИО | Должность | Контакты |
|---|---|---|
| Феофанов Алексей Валерьевич, доц., д.б.н. | г.н.с. | |
| Шаронов Георгий Владимирович, к.ф.-м.н. | с.н.с. | |
| Ефременко Анастасия Владимировна | н.с. | |
| Игнатова Анастасия Александровна | н.с. | |
| Джуманиязова И.Х. | м.н.с. | |
| Орлов Н.А. | м.н.с. | |
| Шматин И.И. | инж.-иссл. | |
| Корабейникова В.Н. | инженер | |
| Лыков Б.Ю. | инженер | |
Ранее здесь работали | ||
| Астапова М.В., к.б.н. | ||
| Денисова К.Р. | ||
| Феофанова А.Е. | ||
| Овчаренко М.Д. | ||
| Соколова М.А. | ||
 Загрузка...
Загрузка...Научные проекты
 Загрузка...
Загрузка...Феофанов Алексей Валерьевич
Москва, ул. Миклухо-Маклая, 16/10 — На карте
Scopus: 7003518369, ResearcherID: K-3082-2012
 Загрузка...
Загрузка...
