Пресс-центр / новости / Наука /
In silico-предсказание трансмембранных димеров для битопных белков
Лаборатория моделирования биомолекулярных систем ИБХ РАН несколько лет занимается компьютерным моделированием димеризации трансмембранных доменов рецепторных тирозинкиназ, играющих ключевую роль в регуляции клеточного роста и деления. В 2013 году методика компьютерного предсказания конформации таких димеров реализована в веб-сервисе PREDDIMER: http://model.nmr.ru/preddimer.
Битопными называют мембранные белки, трансмембранные (ТМ) домены которых состоят всего из одной α-спирали. К таким молекулам относятся, например, рецепторные тирозинкиназы (РТК), участвующие в регуляции клеточного роста и деления. К семейству РТК относятся рецепторы различных факторов роста и инсулина, а также рецептор щелочного pH (родственный инсулиновому), чья функция была открыта в Институте биоорганической химии (ИБХ РАН) несколько лет назад [1].
ТМ-домены играют важную роль в димеризации и активации этих рецепторов, причем функция ТМ-спиралей — передатчиков сигнала между внеклеточными и внутриклеточными фрагментами рецептора — заключается в координации и взаимной ориентации киназных доменов и, как следствие, — реакции собственного фосфорилирования, которая запускает внутриклеточный каскад усиления сигнала. Даже точечные мутации в ТМ-доменах РТК могут приводить к развитию различных наследственных и онкологических заболеваний человека; при этом механизм подобных нарушений, несмотря на интенсивное изучение, до сих пор остается под вопросом.
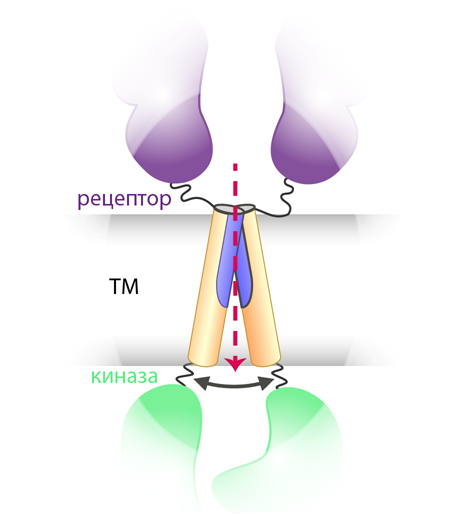
Трансмембранные (ТМ) спирали рецепторных тирозинкиназ являются передатчиками сигнала между внеклеточными (рецепторные домены) и внутриклеточными (киназные домены) фрагментами белков. Их функция связана с координацией и взаимной ориентацией киназных доменов и как следствие — с реакцией собственного фосфорилирования рецептора.
В последние годы существенный прогресс был достигнут в определении структуры ТМ-димеров методом ЯМР-спектроскопии (в основном благодаря работам Лаборатории биомолекулярной ЯМР-спектроскопии ИБХ РАН под руководством профессора Александра Сергеевича Арсеньева). Однако в виду ряда ограничений методики она до сих пор не позволяет однозначно ответить, реализуются ли полученные димерные конформации в клетке и возможны ли конформационные переходы в состояния, альтернативные ЯМР, в процессе функционирования рецепторов и их адаптации к липидному окружению.
Идя навстречу эксперименту, современное молекулярное моделирование позволяет расширить наши представления о структурной организации ТМ-димеров, используя богатый арсенал методик с разной вычислительной эффективностью и предсказательной силой.
Спектр таких методик простирается от простейших алгоритмов, основанных на выявлении мотивов димеризации в ТМ-последовательностях до трудоемких расчетов с применением методов эмпирического силового поля, таких как Монте-Карло конформационный поиск в неявной мембране, «крупнозернистая» и полноатомная молекулярная динамика в явно заданных липидных бислоях, а также различные комбинированные подходы.
В нескольких недавних работах, проведенных в Лаборатории моделирования биомолекулярных систем ИБХ РАН под руководством профессора Романа Гербертовича Ефремова, молекулярное моделирование было использовано для исследования конфомационной гетерогенности и термодинамики ряда ТМ-димеров РТК [2]. Так, было показано, что димеры РТК действительно способны принимать различные конформации, чьи геометрия и относительна стабильность в мембране контролируются липидным составом окружения [2, 3]. В то же время, патологические точечные мутации в ТМ-области могут вызывать конформационные перестройки димеров, влияя на эффективность ассоциации, а также менять заселённость различных состояний в конформационном ансамбле, модулируя активацию РТК [4, 5].
Выступление основного автора упомянутых работ — Полянского А.А. — на семинаре Совета молодых ученых 31 октября 2013 года: «Ключевые аспекты димеризации спиральных доменов в мембранах».
В контексте предсказания ансамблей конфомаций для ТМ-димеров, сотрудники Лаборатории моделирования биомолекулярных систем разработали веб-сервер PREDDIMER (http://model.nmr.ru/preddimer), анонс которого недавно был опубликован в журнале Bioinformatics [6]. Сервер позволяет реконструировать набор димерных структур для заданных ТМ-последовательностей, а также визуализировать полученные конформации в виде 3D-моделей и 2D-карт поверхностной гидрофобности спиралей с отмеченным интерфейсом димеризации. Тестирование сервера на 11 ТМ-последовательностях, для которых ранее были получены 3D-конформации с помощью метода ЯМР-спектроскопии, показывает, что в большинстве случаев алгоритм способен предсказать конформации, близкие к экспериментальной, в пределах 3 Å среднеквадратичного отклонения (а это соответствует довольно высокой точности).
Несмотря на очевидные ограничения PREDDIMER, который оперирует идеальными α-спиралями без явного учета мембранного окружения и поэтому дает «огрубленные» конфигурации димера, полученные результаты предсказаний могут быть использованы как исходные данные для более детального и реалистичного моделирования, а также быстрой оценки возможных вариантов димеризации для заданных ТМ-последовательностей.
Литература
- Пресс-релиз на сайте ИБХ, 10.06.2011, «Рецептор с „нетрадиционной“ ориентацией»;
-
Polyansky A.A., Volynsky P.E., Efremov R.G. (2012). Multistate organization of transmembrane helical protein dimers governed by the host membrane. J. Am. Chem. Soc. 134,
14390–143400; -
Muhle-Goll C., Hoffmann S., Afonin S., Grage S.L, Polyansky A.A., Windisch D., Zeitler M., Buerck J., Ulrich A.S. (2012). Hydrophobic matching controls the tilt and stability of the dimeric platelet-derived growth factor receptor (PDGFR) β transmembrane segment. J. Biol. Chem. 287,
26178–26186; - Velghe A.I., Van Cauwenberghe S., Polyansky A.A., Chand D., Montano-Almendras C.P., Charni S., Hallberg B., Essaghir A., Demoulin J.B. (2013). PDGFRA alterations in cancer: characterization of a gain-of-function V536E transmembrane mutant as well as loss-of-function and passenger mutations. Oncogene, doi:10.1038/onc.2013.218;
-
Volynsky P. E., Polyansky A. A., Fakhrutdinova G. N., Bocharov E. V., Efremov R. G. (2013). Role of dimerization efficiency of transmembrane domains in activation of fibroblast growth factor receptor 3. J. Am. Chem. Soc. 135,
8105–8108; - Polyansky A.A., Chugunov A.O., Volynsky P.E., Krylov N.A., Nolde D.E., Efremov R.G. (2013). PREDDIMER: a web server for prediction of transmembrane helical dimers. Bioinformatics, doi: 10.1093/bioinformatics/btt645.
24 декабря 2013 года

